|
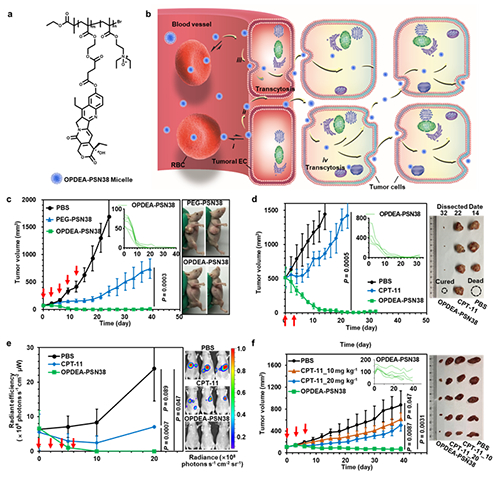 |
图 (a) OPDEA-PSN38胶束的结构;(b)胶束在肿瘤组织中的主动渗透机理图;(c-f)胶束在肝癌皮下小肿瘤模型(c)、大肿瘤模型(d)、原位模型(e)和人源肿瘤异种移植模型(f)中的抑瘤曲线
在国家自然科学基金项目(批准号:51833008)等的资助下,浙江大学申有青教授团队在主动转胞吞型高效抗肿瘤纳米药物的研究领域再次取得新的进展。继此前提出的酶响应型纳米药物的肿瘤主动渗透新机制后(《自然:纳米技术》(Nature Nanotechnology),http://www.nsfc.gov.cn/publish/portal0/tab448/info76443.htm),团队进一步提出了一种简化药物载体结构的策略:即利用能够弱黏附细胞膜、但不黏附蛋白质的高分子为载体,使之同时具备血液长循环性能和不必发生酶催化反应就可以触发肿瘤细胞主动转胞吞的特性。这一策略极大地简化了纳米药物的结构,但更高效地外渗进入肿瘤组织和渗透扩散,将药物递送到瘤内所有细胞,获得极高的疗效,因而具有很高的临床转化潜力。相关研究成果以“具有增强的肿瘤渗透性和长血液循环的细胞膜亲和型聚两性离子-药物键合物(Enhanced tumour penetration and prolonged circulation in blood of polyzwitterion–drug conjugates with cell-membrane affinity)”为题发表在国际著名学术期刊《自然:生物医学工程》(Nature Biomedical Engineering)。论文链接:https://www.nature.com/articles/s41551-021-00701-4。
近年来,纳米药物的临床应用取得了重大进展,其中一些纳米药物已经在临床上应用或处于临床试验阶段,但是几乎所有的纳米药物都未能达到预期的临床疗效。这是由于临床肿瘤的EPR效应弱且呈很强的异质性,导致纳米药物难以从血管进入肿瘤组织;而纳米药物固有的较大尺寸(相对于小分子药物)和肿瘤组织的致密性,使纳米药物难以在实体肿瘤内渗透,无法将药物递送到远离血管的细胞来有效发挥药效。因此,肿瘤血管外渗困难和肿瘤组织渗透困难一直是传统纳米药物难以克服的瓶颈。为了克服药物输送过程中的各种生理屏障,国内外研究人员设计了各种结构复杂的多功能纳米药物。但结构的复杂性不可避免地增加了临床转化的困难。
基于主动转胞吞的纳米药物设计策略能够巧妙地利用肿瘤内细胞密度高的特点,让血管上皮细胞和肿瘤细胞“主动地”在细胞间传递纳米药物,从而不依赖于EPR效应将纳米药物传递到血管外、有效地避开肿瘤微环境对纳米粒子被动扩散的阻碍和尺寸的限制,打破了纳米药物递送过程中面临的外渗难和浸润难的瓶颈。该团队先前设计的主动转胞吞纳米载药体系需要先在肿瘤部位发生酶催化产生胺的反应才能触发肿瘤细胞的主动转胞吞作用,其载体结构相对比较复杂,有待进一步简化载体结构和提高递送效率。
在该研究中,研究人员设计合成了一种含有三级胺氮氧结构的两性离子聚合物OPDEA,它具有不吸附蛋白质却能与细胞膜可逆吸附的特性,因此能够“隐蔽”在血液循环系统中实现长循环和肿瘤富集;另一方面,能快速被肿瘤血管内皮细胞和肿瘤细胞摄取,从而触发主动转胞吞作用并实现高效的肿瘤血管外渗和肿瘤渗透。基于此,研究人员利用OPDEA携载化疗药物7-乙基-10-羟基喜树碱(SN38)制备了以OPDEA为亲水外层、以SN38前药聚合物为疏水内核的肿瘤主动渗透型纳米载药胶束(OPDEA-PSN38)(图a)。尾静脉注射后,该胶束能可逆地吸附到红细胞上而不吸附血浆蛋白,具有较好的血液长循环;一旦到达肿瘤部位,它能弱吸附在肿瘤血管内皮细胞上并触发其转胞吞作用,快速外渗至肿瘤组织中,进而通过肿瘤细胞的转胞吞作用实现高效的肿瘤渗透,能够浸润到乏血管、缺氧甚至坏死区域,从而将药物递送到所有细胞,最终彻底消灭肿瘤组织中所有的肿瘤细胞(图b)。与临床一线化疗药物伊立替康(CPT-11)及其脂质体相比,该纳米药物在多种荷瘤小鼠模型(包括肝癌原位模型和人源肿瘤异种移植瘤模型)中均表现出优异的抑瘤作用,在常规给药剂量下,它不仅能清除起始肿瘤大小为70 mm3的小肿瘤,也能清除起始肿瘤大小为500 mm3的大肿瘤,而且生物安全性良好,不会产生停药反弹等副作用(图c-f)。
因此,OPDEA及其纳米药物以其不与蛋白质吸附却能与细胞膜可逆吸附的特性,实现了血液长循环、不依赖于传统EPR作用的高效肿瘤血管外渗和高效瘤内渗透,治疗高效且结构简单,为临床转化纳米药物的设计提供了新的思路。