——我国学者在人工智能驱动药物设计领域取得进展
 打印
打印
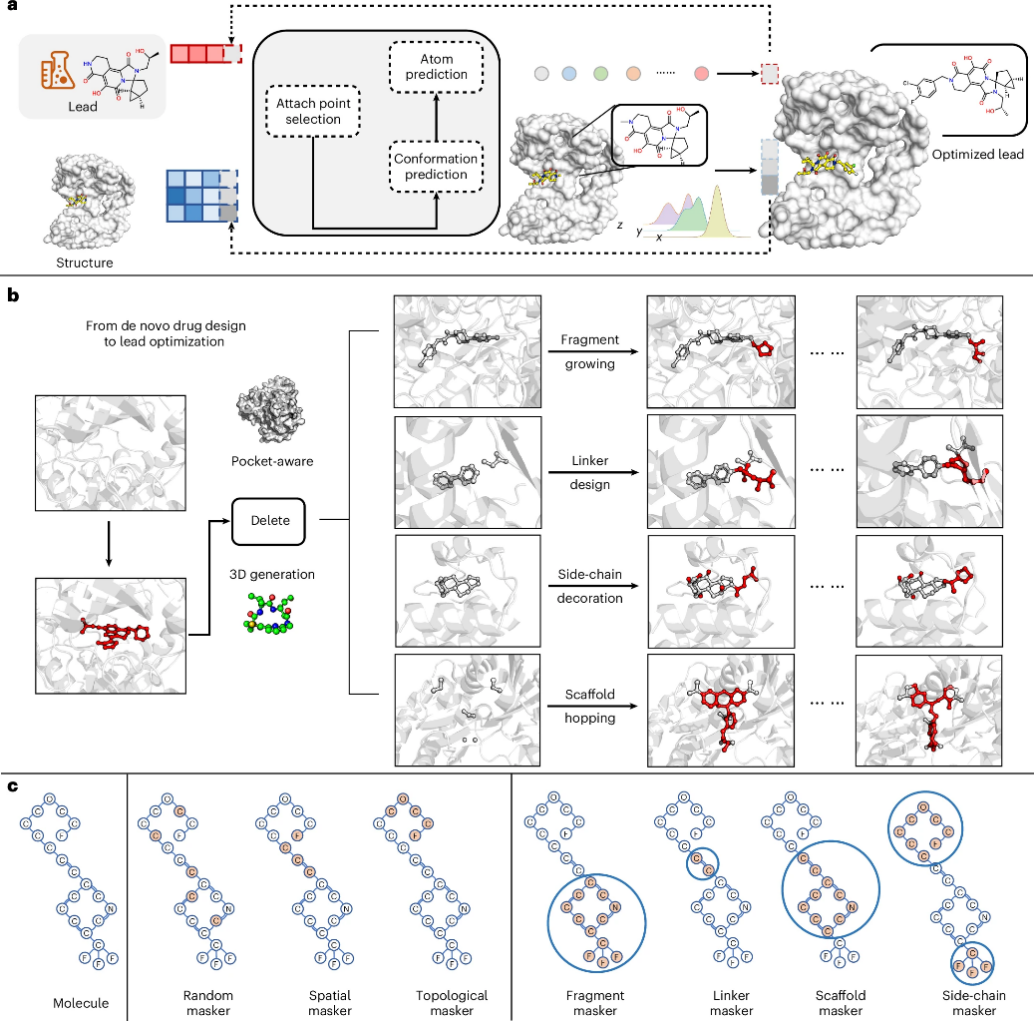
图 Delete模型架构及工作流示意图
在国家自然科学基金项目(批准号:92370130)等资助下,浙江大学侯廷军教授、潘培辰研究员、康玉副教授、谢昌谕教授联合香港科技大学黄湧教授在人工智能驱动药物设计领域取得进展。相关研究成果以“基于蛋白结合口袋的深度先导化合物优化及其在LTK靶向高选择性配体设计中的应用 (Deep lead optimization enveloped in protein pocket and its application in designing potent and selective ligands targeting LTK protein)”为题,于2025年2月20日发表在国际学术期刊《自然·机器智能》(Nature Machine Intelligence)杂志上,论文链接:https://www.nature.com/articles/s42256-025-00997-w。
先导化合物优化是新药研发中的关键环节,但传统计算方法往往难以兼顾分子结构修饰的灵活性与蛋白-配体三维相互作用的精准表征。针对这一难题,研究团队提出了一种基于蛋白结合口袋的深度先导化合物优化方法Delete,将蛋白口袋三维结构信息直接引入深度学习模型,实现了linker设计、片段替换、骨架跃迁及侧链修饰等所有先导化合物优化子任务的全流程整合,能够在统一的生成式框架下完成对候选分子结构的精准优化。
在多个先导化合物优化基准任务上,该方法在分子合理性、结构多样性以及结合构象匹配度等指标上均优于现有主流生成模型,展现出在良好的泛化能力和稳定性。研究进一步以白细胞酪氨酸激酶靶点CLIP1-LTK为示例验证了方法的实际应用潜力,模型生成的最优候选抑制剂在活性与选择性方面表现出显著提升。在后续的实验中,研究者发现该小分子能够抑制LTK下游信号通路的传导,诱导细胞凋亡、阻滞细胞周期,并在体内表现出优异的抗肿瘤效果,药代动力学性质相比于起始小分子有显著提升,实验结果体现了该方法在真实药物设计任务中的可行性。该研究为人工智能在基于结构的先导化合物优化领域提供了新的技术路径,对提升新药研发效率具有重要意义。
