 打印
打印
在科技创新2030-“脑科学与类脑研究”重大项目、国家自然科学基金项目(批准号:32494760、32461160291、31630030、32200784、32521003、31621002)等资助下,中国科学技术大学毕国强教授、刘北明教授和陶长路副研究员团队联合美国加州大学洛杉矶分校等机构,基于自主研发的毫秒级时间分辨冷冻电镜成像技术,成功解析了神经信息传递过程中突触囊泡释放与快速回收的细胞生物物理机制,并提出了“亲吻-收缩-逃逸/融合”(Kiss-Shrink-Run/Collapse)新模型。研究成果以“‘Kiss-shrink-run’ unifies mechanisms for synaptic vesicle exocytosis and hyperfast recycling”(“亲吻–收缩–逃逸”模型-统一突触囊泡胞吐与超快速回收的机制)为题,于2025年10月17日在《科学》杂志发表,论文链接为:https://www.science.org/doi/10.1126/science.ads7954。
大脑功能的实现,依赖于神经元之间高效而精准的突触传递。当动作电位到达突触前终端时,突触囊泡通过释放神经递质实现信号的跨神经元传递。20世纪50年代,伯纳德·卡茨 (Bernard Katz)提出突触传递过程中神经递质的量子化释放假说,奠定了神经信息传递的细胞机制基础。至1970年代初,学界逐渐形成两种相互竞争的突触囊泡释放模型:全融合(Full-collapse)和亲吻-逃逸(Kiss-and-run)。然而,由于囊泡释放过程发生在毫秒时间尺度、结构变化处于纳米空间尺度,技术手段的局限使得神经科学领域关于这两种模型的争议长期悬而未决。
毕国强教授团队通过开发具有毫秒时间分辨的原位冷冻电镜技术,将光遗传学刺激与投入式快速冷冻方法结合,实现了对神经元突触传递过程的毫秒级“动态定格”。研究人员在神经元中表达光敏蛋白,通过激光精准激发动作电位以触发囊泡释放。随后,在设定时间点将载有样品的电镜载网快速落入冷冻剂,实现细胞结构的瞬时固定。通过精确控制光照与冷冻的时间间隔,团队成功实现在4毫秒至300毫秒范围内的不同阶段,捕获到囊泡释放的结构快照。
基于对上千套高分辨率突触三维结构数据的系统分析,研究团队绘制出突触囊泡释放与快速回收的完整过程,并提出全新理论模型-亲吻-收缩-逃逸/融合:在动作电位触发后4 毫秒内,囊泡首先与突触前膜融合形成约4纳米的融合孔(“亲吻”,kiss);随后收缩为表面积减半的小囊泡(“收缩”,shrink);最后,大部分小囊泡在70毫秒内开始以“逃逸”(Run)方式回收,少部分则与突触前膜 “全融合”(Collapse)。
该研究更新了传统认知,揭示囊泡释放并非简单的全融合或亲吻-逃逸,而是包含一个关键的中间收缩阶段。这一“亲吻-收缩-逃逸”模型,不仅统一了争议半个世纪的两种模型,也揭示了神经突触高效与高保真传递的结构基础,为深入理解神经信息传递、突触可塑性以及研究相关脑疾病的机理提供了新视角。同时,该研究所发展的时间分辨冷冻电镜技术为研究细胞内其他动态生命过程提供了创新方法平台。
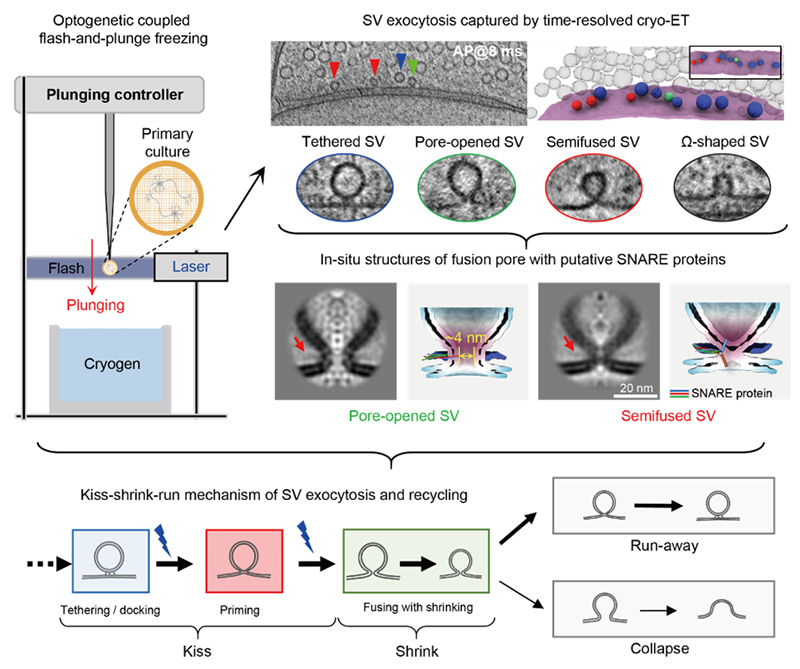
图 利用时间分辨冷冻电镜技术解析突触囊泡释放与快速回收动态过程
