 打印
打印
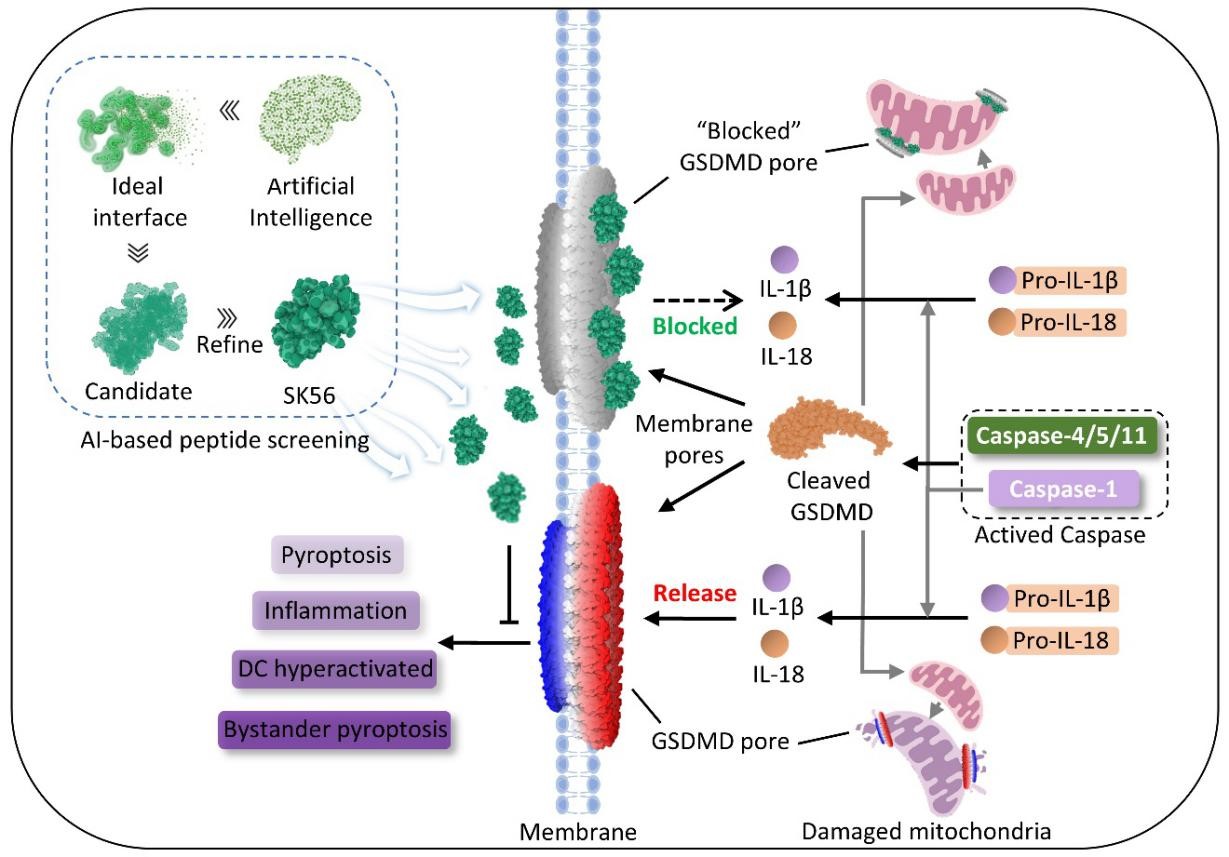
图 AI筛选肽SK56阻断GSDMD-NT孔道抑制细胞焦亡减轻过度炎症
在国家自然科学基金项目(批准号:82222038、82360075、32471178、81903666)等资助下,陆军军医大学大坪医院王淦副研究员、曾灵研究员团队与昆明医科大学附属延安医院孟平副研究员团队合作,在人工智能筛选细胞焦亡抑制剂研究方面取得进展。研究成果以“人工智能辅助筛选的gasdermin D孔道阻断剂延缓细胞焦亡以减轻炎症反应(Delaying pyroptosis with an AI-screened gasdermin D pore blocker mitigates inflammatory response)”为题,于2025年9月15日在《自然·免疫》杂志(Nature Immunology)上在线发表。论文链接:https://www.nature.com/articles/s41590-025-02280-x。
细胞焦亡是一种由gasdermin D(GSDMD)蛋白介导的程序性细胞死亡方式。GSDMD被激活后,其N端结构域(GSDMD-NT)可在细胞膜上形成孔道,导致细胞渗透压失衡、内容物释放,从而引发强烈的炎症反应。该过程在脓毒症、自身免疫病等炎症性疾病的发生机制中起重要作用。近年来研究发现,细胞外囊泡(EVs)可携带GSDMD-NT孔道并将其传递至邻近细胞,诱导细胞焦亡,实现炎症信号在细胞间 “传播”,这种现象在脓毒症患者中尤为显著。临床相关患者的治疗时间多在GSDMD-NT孔道形成之后,而现有的细胞焦亡抑制剂多靶向于GSDMD蛋白切割激活过程,对已形成的GSDMD-NT孔道无阻断作用,因此开发直接阻断GSDMD-NT孔道功能的新型抑制剂具有重要临床价值。
该合作研究团队通过自主开发的深度学习原子生成模型(Transformer),对可抑制GSDMD-NT孔道功能的肽类分子进行大规模虚拟筛选,并结合细胞模型、人肺泡类器官及临床前动物模型开展系统性验证,成功鉴定出一种候选多肽分子SK56。该分子能够特异性靶向GSDMD-NT孔道,且不影响白细胞介素-1β的加工和GSDMD的激活过程,并在细胞膜孔道形成后进入细胞,与线粒体上的GSDMD-NT孔道结合,减轻线粒体损伤和活性氧释放。同时,SK56通过静电相互作用与ESCRT蛋白(CHMP4等)结合,加速膜泡形成以减少膜损伤和加快膜修复,从而抑制细胞焦亡。此外,SK56还能减少树突状细胞对焦亡细胞膜碎片的吞噬,抑制树突状细胞超激活,进而减少抗原呈递和抑制炎症反应。在人肺泡类器官模型中,SK56可有效阻断焦亡在细胞间的“传播”。在脓毒症小鼠模型延迟给药实验中,即使在成功造模后4~16小时给药干预,SK56仍能显著提升脓毒症小鼠的存活率(图)。
该研究通过人工智能筛选的肽类分子SK56,可直接与GSDMD-NT孔道相结合抑制焦亡反应,并通过细胞ESCRT膜修复系统减缓细胞死亡,为焦亡引发的炎症疾病治疗提供了新思路。
