 打印
打印
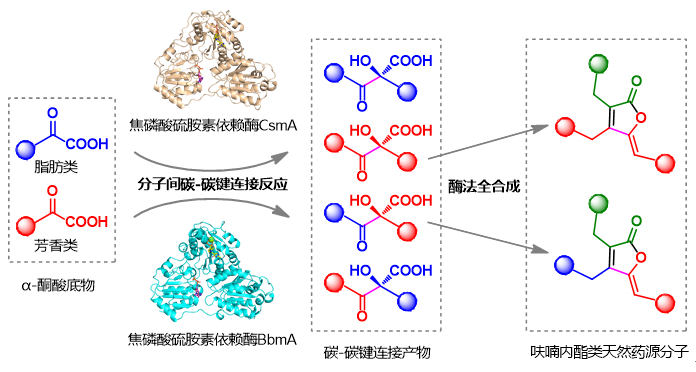
图 新颖焦磷酸硫胺素依赖酶催化合成天然药源分子
在国家自然科学基金项目(批准号:82325046、82273829)等资助下,北京大学药学院马明教授团队在在天然药源分子生物合成研究方面取得进展,相关成果以“两个焦磷酸硫胺素依赖酶的结构研究以及它们在碳-碳键连接反应方面的催化应用(Structural insights into two thiamine diphosphate-dependent enzymes and their synthetic applications in carbon–carbon linkage reactions)”为题,于2025年5月14日在《自然·化学》(Nature Chemistry)杂志在线发表。论文链接:https://doi.org/10.1038/s41557-025-01822-y。
焦磷酸硫胺素依赖酶是以焦磷酸硫胺素(维生素B1的磷酸化形式)为辅因子的一类酶,它们在氨基酸代谢、糖代谢等初级代谢中扮演重要角色。近年来这类酶被发现也参与生物体中次级代谢产物(包括一些天然药源分子)的生物合成,它们催化特殊的分子间碳-碳键形成反应,构建了天然药源分子的化学骨架,其选择的底物类型与初级代谢中截然不同。然而截至目前,这些天然药源分子生物合成酶的三维结构未得到解析,其催化反应的底物选择性和立体选择性未得到阐明,极大限制了在天然药源分子碳骨架构建中的催化应用。
研究团队从构建的海洋细菌菌种库中发现了一种天然产物,并通过基因组测序、进化树分析发现了两个负责天然产物生物合成的焦磷酸硫胺素依赖酶;进一步解析了焦磷酸硫胺素依赖酶、辅因子和底物的复合物晶体结构,揭示了它们催化α-酮酸碳-碳键连接反应的底物选择性和立体选择性结构基础;针对活性位点关键氨基酸的定点突变理性改造了两个酶的催化功能,并催化合成了360个碳-碳键连接产物,包括354个新化合物;进一步构建了多酶级联催化体系,通过提供简单的原料分子,酶法全合成了36个结构复杂的呋喃内酯类抗生素类似物(图)。
该研究揭示了天然药源分子生物合成中新颖的酶催化机制,为合成生物学规模化制造复杂天然药物提供了酶催化元件。
