 打印
打印
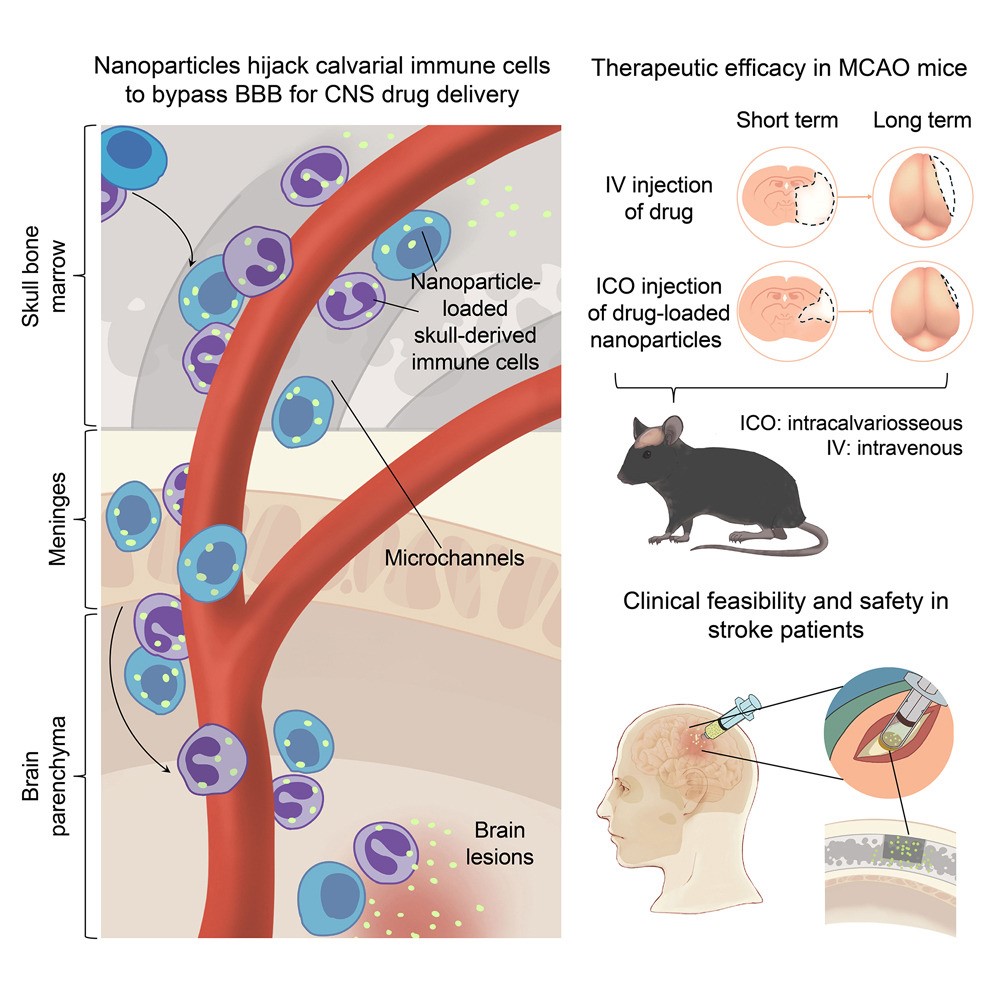
图 颅骨骨髓免疫细胞递送纳米颗粒至脑实质病灶
在国家自然科学基金项目(批准号:62350710211、82425101)等资助下,首都医科大学附属北京天坛医院王伊龙教授团队与清华大学张明君教授团队合作,在中枢神经系统药物递送治疗脑卒中研究方面取得新进展。研究成果以“纳米颗粒‘劫持’颅骨免疫细胞实现中枢神经系统药物递送和卒中治疗(Nanoparticles hijack calvarial immune cells for CNS drug delivery and stroke therapy)”为题,于2026年1月16日在线发表于《细胞》(Cell)杂志。论文链接:https://doi.org/10.1016/j.cell.2025.12.008。
中枢神经系统(central nervous system, CNS)疾病治疗药物的研发长期面临较高的临床试验失败率,其关键制约因素之一在于血脑屏障(blood brain barrier, BBB)对多数药物通透性限制,导致脑内有效药物蓄积不足,从而影响治疗效果。王伊龙教授团队前期研究发现,借助颅骨骨髓与硬脑膜之间的天然微通道,可以实现药物向大脑的有效递送。然而,CNS疾病通常存在特异性的易感脑区,缺乏靶向性的给药策略往往引发不良反应。
研究团队发现,通过颅骨骨髓微创注射,将白蛋白纳米颗粒输入颅骨骨髓腔,纳米颗粒能够被颅骨骨髓中的免疫细胞高效摄取,形成“颅骨免疫细胞微纳机器人”,并沿前颅骨-脑膜微通道向CNS迁移,绕过BBB实现CNS药物递送。在啮齿类缺血性脑卒中模型中,该迁移过程显著增强,纳米颗粒在脑膜和脑卒中病灶区高度富集。与传统静脉注射相比,在药物剂量仅为其约1/15的情况下,该策略仍能显著减小脑梗死体积、缓解脑水肿,改善了短期和长期预后。基于该经“颅骨骨髓—硬脑膜—胶质淋巴系统”的递药策略,研究团队开展了探索性临床研究(SOLUTION试验),提示颅骨内注射途径在恶性大脑中动脉梗塞治疗中的转化可行性(图)。
该研究揭示了通过颅骨骨髓-脑膜微通道与免疫细胞“载药”的新型递药机制,为CNS疾病的精准给药及机制研究提供了新的研究范式,也为基于颅骨骨髓-硬脑膜-胶质淋巴系统的CNS疾病治疗提供了新的技术路径。
