 打印
打印
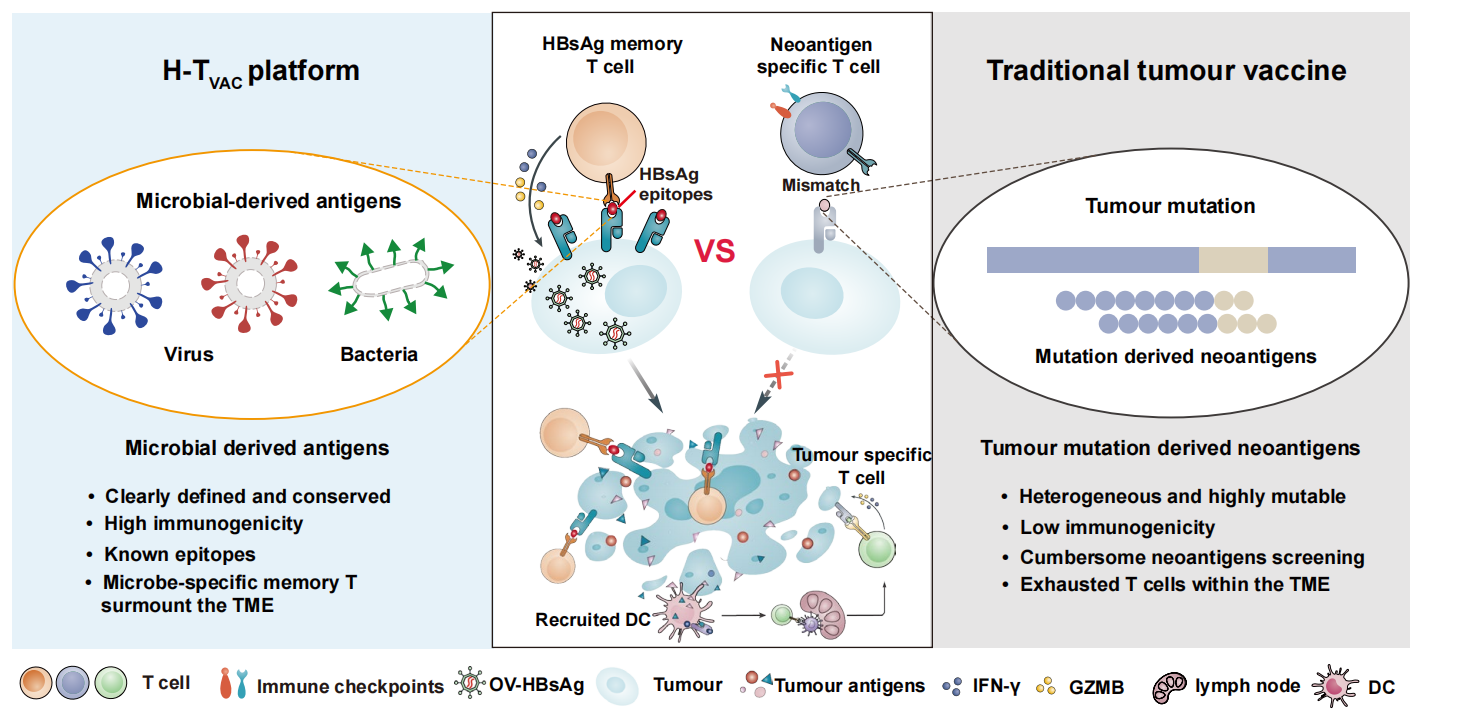
图 基于H-TVAC平台的通用型癌症疫苗概述及优势
在国家自然科学基金项目(批准号:82304428)等资助下,中国药科大学杨勇教授和王文广副研究员、柳州市柳铁中心医院左曙光副研究员、南京大学胡一桥教授、中国药科大学赵维俊副研究员等开展合作,在通用型肿瘤疫苗研究领域取得进展。研究成果以“HBsAg标记的肿瘤疫苗系统通过病毒特异性记忆T细胞清除实体瘤(HBsAg-tagged tumour vaccine system eliminates solid tumours through virus-specific memory T cells)”为题,于2025年11月17日在线发表于《自然生物医学工程》(Nature Biomedical Engineering)杂志。论文链接:https://doi.org/10.1038/s41551-025-01555-w。
肿瘤新抗原疫苗通过诱导机体产生肿瘤特异性免疫应答,为精准治疗肿瘤提供了新思路。目前,国际疫苗研究正聚焦于利用肿瘤突变,筛选和设计个体化的新抗原疫苗,相关临床试验已经超过100多项。然而,由于新抗原较低的免疫原性(仅约15%~30%的新抗原能够诱导T细胞产生)、实体瘤高度的异质性以及肿瘤免疫微环境(TIME)的抑制作用等原因,实体瘤对这些个性化的肿瘤新抗原疫苗治疗响应率较低,仍需进一步优化。
研究团队构建了乙肝病毒抗原(HBsAg)标签化肿瘤疫苗系统H-TVAC,利用乙型肝炎病毒特异性免疫记忆实现实体瘤的高效清除。该系统结合mRNA疫苗诱导持久的HBsAg特异性记忆T细胞,并通过TK缺陷型痘苗病毒在肿瘤细胞内特异性表达HBsAg,赋予肿瘤细胞病毒样免疫标签。在MC38高突变负荷结直肠癌模型中,H-TVAC成功激发针对11种新抗原的特异性免疫应答,不仅通过病毒模拟机制实现初始杀伤,更重要的是通过表位扩散效应重塑免疫识别谱,实现对异质性肿瘤的全面清除。在B16F10双侧肿瘤模型、4T1三阴性乳腺癌等多种免疫抑制型肿瘤模型中,H-TVAC有效抑制了肿瘤转移和复发,通过“病毒标签-记忆T细胞-表位扩散”的级联反应,成功将外源性病毒免疫转化为内源性肿瘤免疫,为克服实体瘤的免疫耐受提供了新的治疗策略(图)。
该研究证实H-TVAC系统不仅成功利用高度保守的病毒抗原绕过了传统新抗原疫苗的筛选瓶颈,更通过协同激活记忆性与天然T细胞应答,实现了对异质性肿瘤的广谱清除,其诱导的病毒特异性记忆T细胞在免疫抑制微环境中仍能维持高效杀伤活性。该研究成果为开发兼具高效性与普适性的通用型肿瘤疫苗提供了新思路。
