 打印
打印
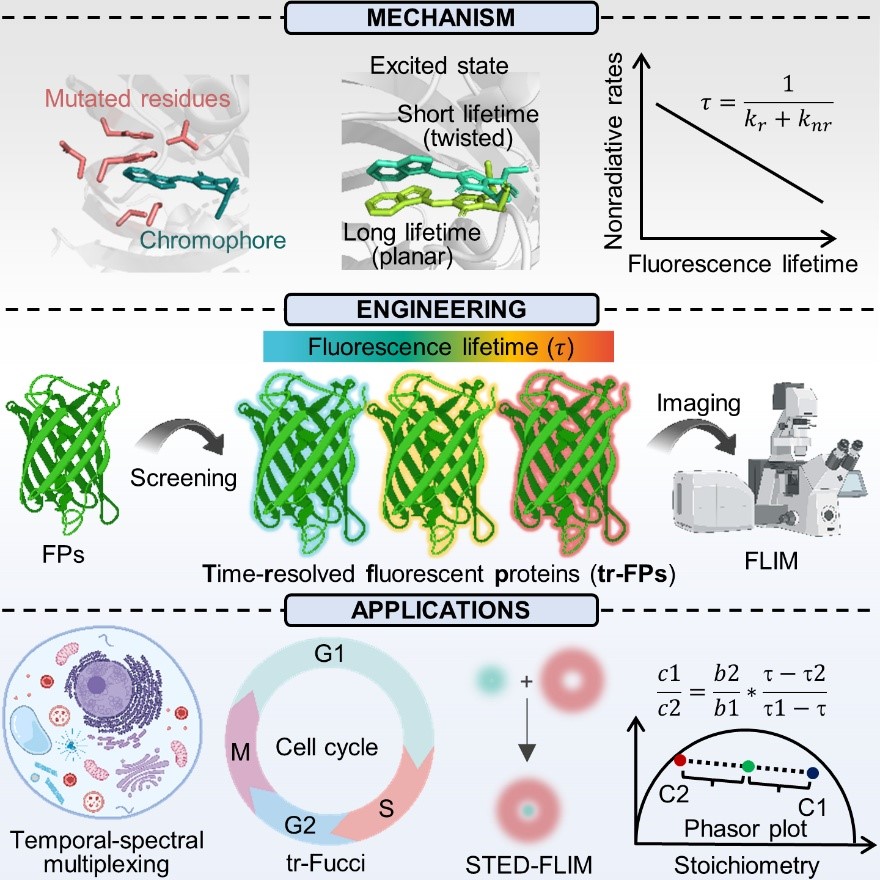
图 tr-FPs荧光寿命调控机制及其在多重成像中的应用
在国家自然科学基金项目(批准号:22494700、22494702、22477102、82273257、32450793、22222410、22374148)等资助下,西湖大学张鑫团队于2025年9月22日在《细胞》(Cell)期刊在线发表题为“Time-resolved fluorescent proteins expand fluorescent microscopy in temporal and spectral domains”的研究论文,论文链接为https://www.cell.com/cell/abstract/S0092-8674(25)01027-X。该研究发展了一类新型时间分辨荧光蛋白(简称tr-FP),通过解析并调控这类蛋白的荧光寿命特性,破解了活体细胞多重成像的技术问题。
荧光显微镜已成为生命科学研究的核心工具,目前主流检测方式为基于荧光强度的稳态成像,而时间分辨荧光(即荧光寿命)则为成像额外提供了光谱维度之外的关键信息维度。尽管荧光蛋白家族在光谱特性上覆盖度已十分丰富,包含激发/发射波长、亮度、光稳定性等核心指标,但学界对荧光寿命的调控机制研究仍较为薄弱;同时,传统光谱拆分方法在同步检测超过6个靶标时会出现严重信号叠加,极大限制了多重成像的应用场景。相比之下,荧光寿命成像的核心优势在于可在同一光谱通道内区分不同荧光分子,因此开发具备不同寿命特征的荧光蛋白,已成为突破活细胞多靶标成像限制的关键方向。
在本研究中,上述团队围绕可见光区(383~627 nm)荧光蛋白展开攻关,成功构建出新型时间分辨荧光蛋白家族(简称tr-FPs),其荧光寿命可在1~5 ns范围内实现精确调控。通过分子动力学模拟,研究人员进一步揭示了其调控机制:发色团周围氨基酸的定点突变可精准调控蛋白激发态下的构象变化,进而影响非辐射跃迁速率,最终实现对荧光寿命的有效调节。这一机制的阐明,为荧光蛋白的理性设计提供了核心理论依据。基于这一工具,团队实现了在铁死亡、氧化应激等条件下活细胞内9种不同靶蛋白的多重成像,并将传统细胞周期检测系统(Fucci)升级为仅需单一光谱通道的时间分辨Fucci技术(简称tr-Fucci),从而释放其他通道用于观测细胞活动。此外,团队还将tr-FP与超分辨荧光寿命显微技术结合,成功同步观测活细胞中4种细胞器与骨架蛋白,并实现了细胞蛋白质化学计量比的定量分析。tr-FP的开发为荧光蛋白的设计与应用提供了重要方案,其不仅可拓展至各类基于荧光蛋白的技术中,还能通过提升系统复杂性与定量精度为生命科学研究带来新机遇。
