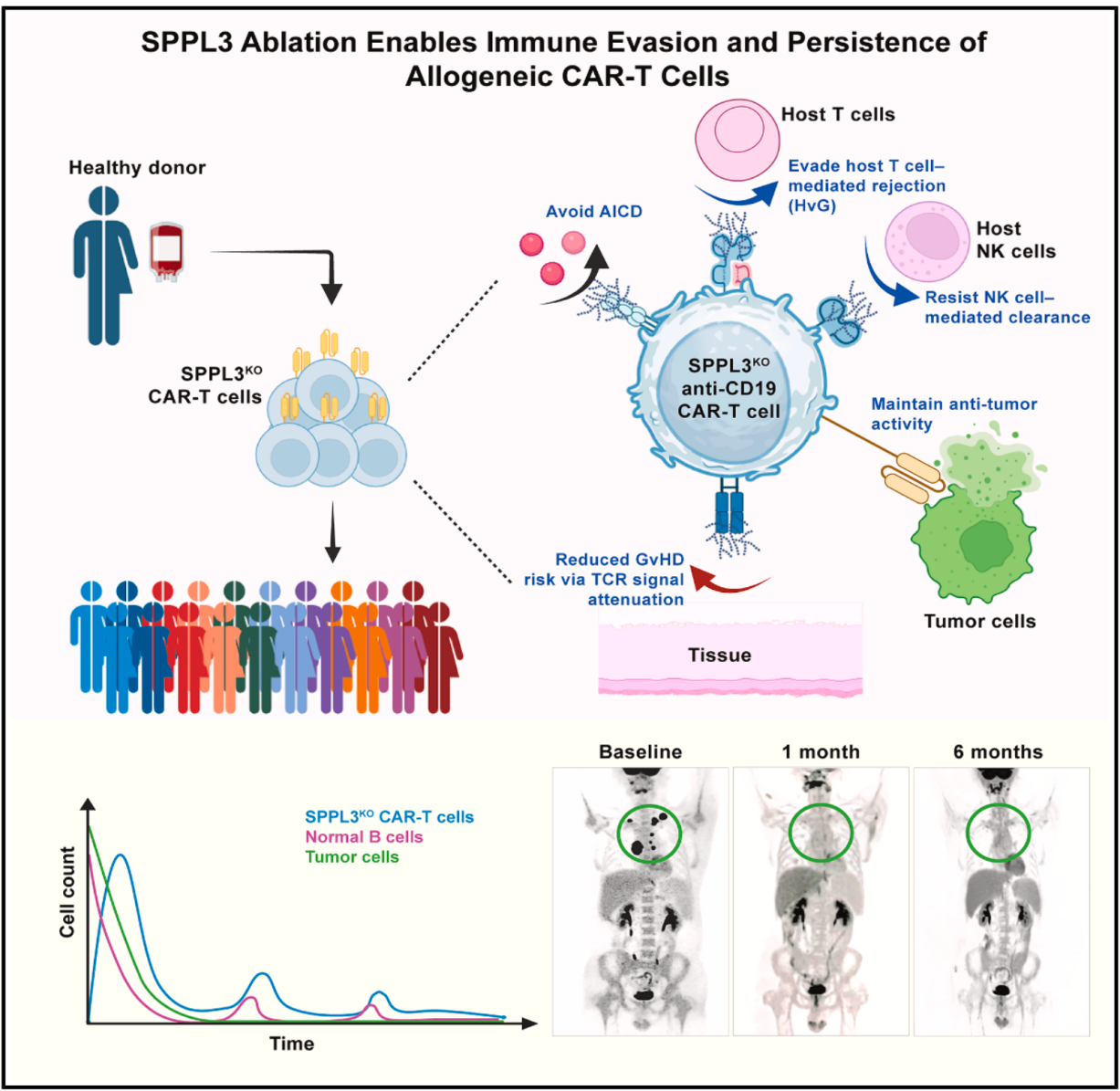
图 SPPL3敲除导致同种异体CAR-T细胞免疫耐受并提升持久性
在国家自然科学基金项目(批准号:82341207、82341208)等资助下,北京大学魏文胜团队、解放军总医院韩为东团队与博雅辑因团队合作在通用型CAR-T研究领域方面取得新进展。研究成果以“糖基化屏蔽赋能TCR保留型同种异体CAR-T疗法(Glycan shielding enables TCR-sufficient allogeneic CAR-T therapy)”为题,于2025年8月21日在《细胞》(Cell)杂志上在线发表。论文链接: https://www.cell.com/cell/fulltext/S0092-8674(25)00910-9。
尽管自体CAR-T细胞疗法在B细胞恶性肿瘤治疗中取得革命性突破,但在运输、产品质量以及患者适用性等方面仍面临挑战。“通用型CAR-T”(异体来源CAR-T),即直接利用健康供体T细胞改造后输入患者,可实现现货化和规模化生产。然而,在异体环境中如何实现持久存活并避免排斥反应仍是其尚未攻克的核心瓶颈。
研究团队通过全基因组CRISPR筛选,鉴定出糖基化调控基因信号肽肽酶样 3(SPPL3)。敲除SPPL3能显著提高T细胞表面的整体糖基化水平,形成致密的糖基修饰层,即所谓的“糖苷盾”,限制了配体可及性,减少了异体免疫反应。SPPL3的基因编辑并未影响CAR-T的抗肿瘤效能,却显著提升了免疫耐受性和持久性。采用SPPL3缺失、T细胞受体(TCR)缺陷的抗CD19异体CAR-T细胞治疗9例复发/难治性B细胞非霍奇金淋巴瘤(B-NHL)患者,I期临床试验结果显示,安全性方面未出现移植物抗宿主病(GvHD),但CAR-T在体内的持续时间有限。反向转化研究揭示了TCR在维持T细胞持久性中的关键作用。基于此,研究团队在3例淋巴瘤或白血病患者中评估了SPPL3缺失、TCR完整的CAR-T疗法的安全性,未观察到GvHD的临床表现,CAR-T细胞在患者体内可持续存在6个月以上。研究结果证实SPPL3缺失诱导的糖基化重塑能够突破异体CAR-T的免疫屏障,而内源性TCR信号对细胞持久性具有不可替代的作用(图)。
该研究揭示了SPPL3靶向编辑不仅保留了CAR介导的抗肿瘤效能,还显著增强了免疫耐受性与体内持久性,提供了一种能够保留TCR的通用型CAR-T的可行方案,为通用型CAR-T的设计与开发提供了全新的策略范式。