图 AIM平台的设计原理和功能
在国家自然科学基金项目(批准号:22425071、22337001)等资助下,北京大学伊成器团队于2026年1月2日在《自然·生物技术》(Nature Biotechnology)期刊上发表了题为“Single-strand deaminase-assisted editing for functional RNA manipulation”的研究论文,论文链接为https://www.nature.com/articles/s41587-025-02956-7。该研究建立了一种由单链脱氨酶辅助的可调节RNA信息操纵平台AIM(adjustable RNA information manipulation),突破了现有RNA碱基编辑工具“单点编辑”的限制,实现了在靶向区域内对不同数量、多种类型碱基的可控与精准操纵。
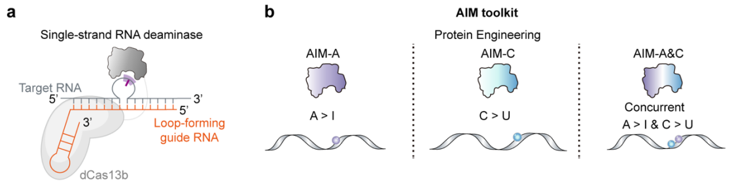
可编程RNA编辑因其不改变基因组且具有可逆性,在基础研究和疾病治疗中具有独特优势。然而,现有工具难以实现多核苷酸层面的复杂操纵。针对这一问题,上述研究团队构建了AIM平台,其核心是由RNA靶向的dCas13、偏好单链RNA底物的脱氨酶TadA,以及特殊设计的可成环向导RNA(Loop-Forming gRNA, LF-gRNA)组成。LF-gRNA可在靶RNA上诱导形成局部单链“环区”,暴露编辑底物,同时通过两侧双链结构抑制非靶向编辑。通过调节环区大小,AIM实现了编辑窗口的灵活可控。
在此基础上,研究团队通过理性设计获得多种TadA变体,构建了三类不同功能的AIM系统:AIM-A/Amax(A-to-I编辑)、AIM-C/Cmax(C-to-U编辑)以及AIM-A&C/A&Cmax(A与C同时编辑)。依托多位点编辑能力,AIM在UAA提前终止密码子通读中展现出独特优势,实现了同一密码子内双A碱基的同步编辑,并在囊性纤维化细胞模型和杜氏肌营养不良小鼠模型中恢复了全长蛋白表达和功能。此外,AIM还可在RNA水平改写关键磷酸化相关密码子,调控蛋白稳定性,为翻译后修饰调控提供了新策略。研究团队还对AIM的特异性和安全性进行了评估:AIM在转录组层面的非靶向编辑处于较低水平,不影响整体基因表达,也未引发DNA脱靶和免疫激活反应,表现出良好的特异性和安全性。