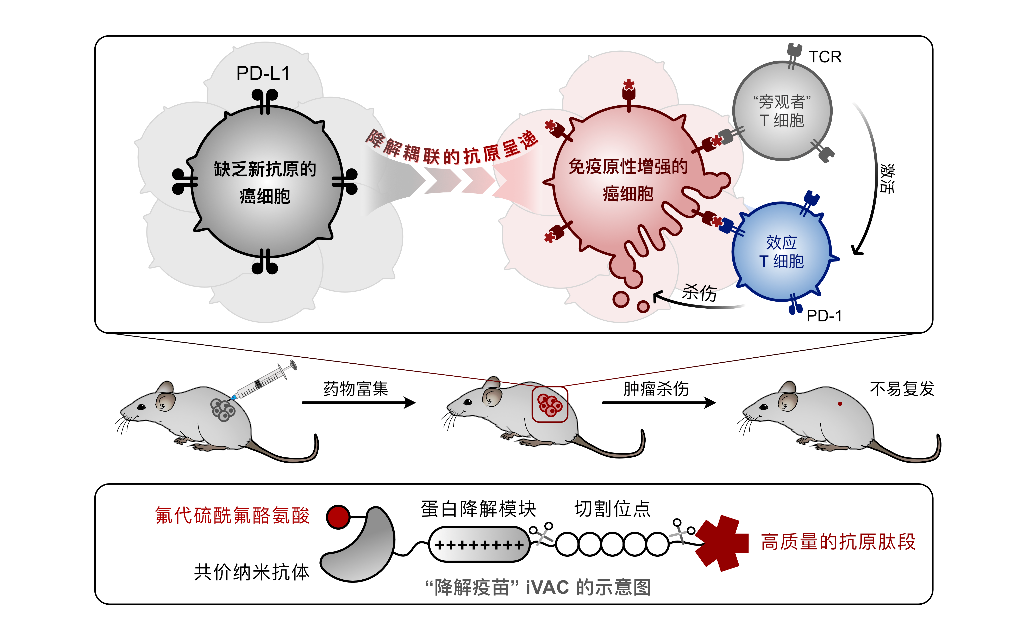
图 瘤内疫苗嵌合体介导抗原呈递与抗肿瘤免疫响应
在国家自然科学基金项目(批准号:21937001、22477083)等资助下,北京大学陈鹏团队、联合席建忠团队以及深圳湾实验室团队,在肿瘤免疫治疗领域取得进展。研究团队提出了一种基于膜蛋白靶向降解的肿瘤免疫原性“原位激活”策略,通过瘤内疫苗嵌合体iVAC (Intratumoural vaccination chimera),促进癌细胞表面免疫检查点PD-L1蛋白的内吞和降解,同时使肿瘤细胞呈递出来源于病毒等的抗原肽段,从而激活机体固有的抗肿瘤免疫响应。该工作以“利用免疫检查点降解耦联的抗原呈递构建新型肿瘤疫苗(Intratumoural vaccination via checkpoint degradation-coupled antigen presentation)”为题,于2026年1月8日在线发表于《自然》(Nature)期刊。论文链接:https://doi.org/10.1038/s41586-025-09903-1。
由于抗原呈递通路被抑制、肿瘤细胞基因突变数量有限等多重原因,肿瘤表面的新抗原数量通常有限,这使得效应T细胞无法识别肿瘤,进而导致现有的免疫检查点阻断疗法响应率有限。如何恢复肿瘤的免疫原性并激活患者体内的特异性T细胞是当前免疫治疗面临的难题。研究团队设计并制备了一种由共价纳米抗体、蛋白降解模块、高质量抗原肽段构成的嵌合体-iVAC。该嵌合体分子利用具有邻近反应活性的氟代硫酰氟酪氨酸,可特异性地与PD-L1蛋白发生共价交联并诱导靶蛋白进入溶酶体降解,从而解除肿瘤的免疫抑制状态。与此同时,肿瘤的抗原呈递通路被激活,iVAC 分子负载的高质量抗原肽段进一步被加工、组装,最终以MHC-I-肽段复合物 (MHC-Peptide Complex)的形式被呈递至肿瘤表面,激活肿瘤原位的记忆T细胞,进而引发显著的肿瘤杀伤效果。实验表明,这一“降解耦联的抗原呈递”过程,不仅能在小鼠模型中高效清除肿瘤并建立免疫记忆,还能在临床患者来源的“肿瘤样细胞簇模型”中激活并重定向人体内广泛存在的病毒特异性“旁观者”T细胞来杀伤肿瘤,实现了对肿瘤微环境的炎性重塑。