|
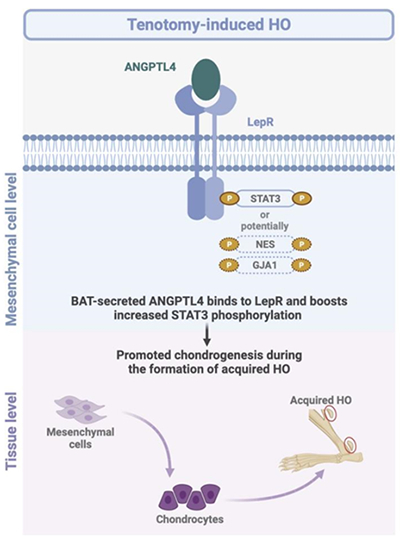 |
图 ANGPTL4通过识别并结合LepR参与异位骨化形成的机制模式图
在国家自然科学基金项目(批准号:82301002、82202654、92268204、81991511)等资助下,南方医科大学白晓春教授团队在异位骨化形成机制研究方面取得进展。研究成果以“ANGPTL4结合瘦素受体调控异位骨化形成(ANGPTL4 binds to leptin receptor to regulate ectopic bone formation)”为题,于2023年12月26日在线发表于《美国科学院院刊》(PNAS)杂志。论文链接:https://www.pnas.org/doi/10.1073/pnas.2310685120。
异位骨化(heterotopic ossification,HO)是一种在机体软组织中形成骨组织的病理现象,常由创伤、手术、烧伤或中枢神经系统损伤等因素引起,给患者带来疼痛和运动功能障碍等问题。由于其病理发生机制仍未阐明,目前尚无特异性治疗药物。以往细胞谱系示踪小鼠的研究证据提示,HO主要来自损伤后间充质干细胞成软骨分化。因此,深入探寻HO中间充质干细胞的软骨分化机制,对于探索HO治疗的新靶点,具有重要的科学意义与临床价值。
该研究团队发现,瘦素缺乏的ob/ob小鼠在肌腱断裂术后会出现HO形成,而瘦素受体(LepR)缺乏的db/db小鼠却不会发生该现象,提示LepR可能存在新的配体并介导HO的形成;条件性敲除小鼠实验研究发现,LepR在PRRX1+间充质干细胞成软骨分化过程中起重要作用;质谱分析和表面等离子体共振亲和力测定研究发现,血管生成素样蛋白4(angiopoietin-like protein 4,ANGPTL4)在HO模型的小鼠血清中富集,并且较瘦素具有与LepR更高的亲和力。该团队通过分子对接计算机模拟,并利用免疫共沉淀和基因敲除小鼠验证,发现ANGPTL4的C末端和LepR的N末端存在相互作用;并进一步揭示了创伤后棕色脂肪组织合成并分泌ANGPTL4至血液,在HO部位与PRRX1+间充质干细胞上的LepR直接结合,激活STAT3信号通路促进间充质干细胞成软骨分化,从而导致HO形成的分子机制;敲除PRRX1+间充质干细胞的LepR、ANGPTL4或清除LepR+细胞均抑制软骨的形成及HO的发展(图)。
该研究鉴定并发现了ANGPTL4是LepR的一种新配体,同时揭示了ANGPTL4在间充质干细胞中通过结合LepR促进HO形成的分子机制,为临床治疗获得性HO提供了新的潜在靶点。