|
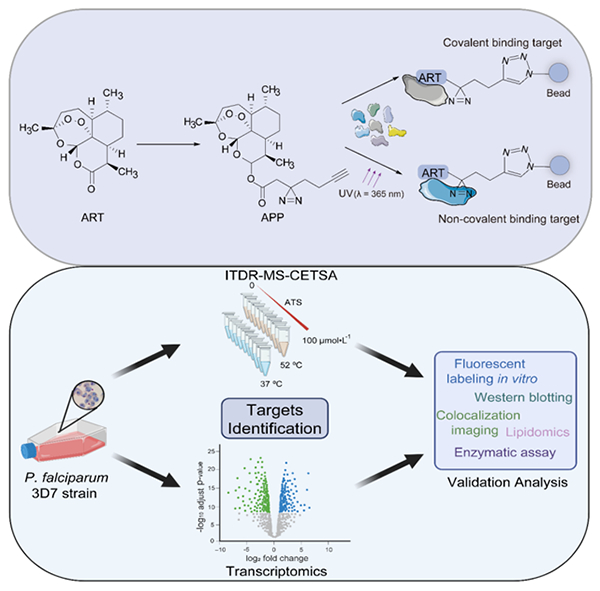 |
图 采用多种策略探究青蒿素抗疟靶点和作用机制
在国家自然科学基金项目(批准号:82141001、82074098、82274182)等资助下,中国中医科学院青蒿素研究中心王继刚研究员团队,在青蒿素抗疟靶标鉴定和作用机理解析方面取得系列进展,研究成果连续发表三篇学术论文:(1)以“采用光亲和标记策略进行化学蛋白质组解析青蒿素的抗疟靶标(Chemical proteomic profiling with photoaffinity labeling strategy identifies antimalarial targets of artemisinin)”为题,于2023年3月5日在《中国化学快报》(Chinese Chemical Letters)杂志上在线发表,论文链接:https://doi.org/10.1016/j.cclet.2023.108296;(2)以“通过识别关键靶蛋白剖析青蒿素的抗疟机制(Profiling the Antimalarial Mechanism of Artemisinin by Identifying Crucial Target Proteins)”为题,于2023年6月24日在《工程》(Engineering)杂志上在线发表,论文链接:https://doi.org/10.1016/j.eng.2023.06.001;(3)以“多组学剖析Kelch13突变型恶性疟原虫的阶段性青蒿素耐受机制(Multi-omics dissection of stage-specific artemisinin tolerance mechanisms in Kelch13-mutant Plasmodium falciparum)”为题,于2023年6月2日在《药物耐药新进展》(Drug Resistance Updates)杂志上在线发表,论文链接:https://doi.org/10.1016/j.drup.2023.100978。
疟疾作为一类具有严重危害的传染性疾病与重要公共卫生问题,给全球人类健康带来较大的危害并造成巨大的社会经济负担。近几十年来,青蒿素和基于青蒿素的联合疗法极大地遏制了全球疟疾流行。青蒿素(ART)是少数几种在疟原虫的整个无性红细胞阶段都具有抗疟疾活性的药物之一。研究团队前期已通过化学蛋白质组学技术(ABPP)揭示了青蒿素独特的过氧化物桥被血红素激活致使其烷基化大量疟原虫蛋白而杀灭疟原虫的机制。然而,由于恶性疟原虫具有复杂的生活周期,青蒿素在疟原虫不同生活周期靶标谱的激活程度差异尚未得到系统研究,关键作用靶标及其参与的相关生理进程仍不明确。此外,逐渐出现的青蒿素耐药现象阻碍了消灭疟疾的进程,引发了社会各界极大担忧,同时也对深入研究青蒿素抗疟机理,以及针对其耐药的解决方案提出更高要求。
该团队基于ABPP的光亲和标记策略合成了一种具有光亲和特性的青蒿素探针,探索了疟原虫中青蒿素的潜在靶蛋白(乳酸脱氢酶、磷酸丙糖异构酶、甘油醛-3-磷酸脱氢酶) 和结合模式,发现了青蒿素可以通过共价和非共价修饰与疟原虫蛋白结合,共同发挥青蒿素的抗疟作用。同时利用无需对药物进行结构修饰的生物物理技术-细胞热转移分析(CETSA)方法对青蒿素的关键抗疟靶标(延长因子-α、过氧化物蛋白、磷酸乙醇胺甲基转移酶、乙醇胺激酶)和潜在的作用途径进行了探究,表明青蒿素可能通过干扰氧化应激、脂质代谢和蛋白合成产生抗疟作用。此外,针对目前备受世界关注的青蒿素耐药现象,该团队利用多组学策略对疟原虫Kelch13基因突变导致的青蒿素耐药进行了深入研究,揭示了青蒿素耐药发生和疟原虫在红细胞内三个独特的生活周期(环期、滋养体期、裂殖体期)存在相关性,其中环期作用靶标最少,可能是导致药物敏感度降低的原因。该项研究对青蒿素在不同虫株中的靶标和阶段异质性及其与耐药机制的关联进行解析,阐释了Kelch13突变型恶性疟原虫的部分耐药机制。
综上所述,研究团队采用不同的研究策略对青蒿素抗疟作用机理进行了全面深入的解析,为进一步探索青蒿素的抗疟作用机理以及研制和优化现有临床用药和开发新型抗疟药物提供参考。