|
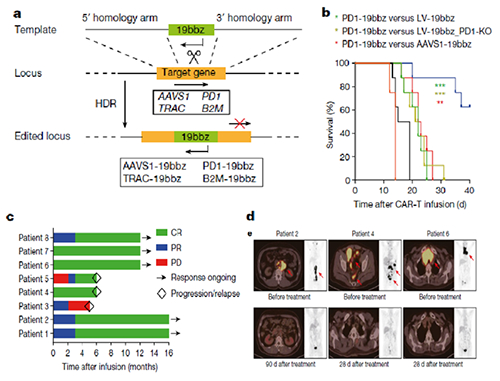 |
图 非病毒定点整合CAR-T 细胞治疗复发/难治B细胞淋巴瘤。(A)抗CD19的CAR序列通过CRISPR-Cas9的同源重组特异性整合到目标位点;(B)PD1-19bbz CAR-T细胞治疗的小鼠生存率得到显著提高;(C)难治复发淋巴瘤患者中,客观缓解率高达100%,完全缓解率达到87.5%;(D)三个典型病人治疗前后PET-CT检查结果
在国家自然科学基金项目(批准号:81772622、81730008、81770201)等资助下,浙江大学黄河教授/胡永仙主任医师团队和邦耀生物刘明耀教授/张楫钦副研究员团队在非病毒定点整合CAR(chimeric antigen receptor)-T 细胞治疗复发/难治 B 细胞淋巴瘤研究中取得进展。研究成果以“CRISPR/Cas 介导的非病毒定点整合CAR-T 细胞治疗复发/难治性 B 细胞非霍奇金淋巴瘤具有高安全性及有效性(Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL)”为题,于2022年8月31日发表在《自然》(Nature)杂志,论文链接:https://www.nature.com/articles/s41586-022-05140-y。
近年来,CAR-T细胞治疗迅速发展,在癌症治疗中显示出巨大的潜力。当前,CAR-T细胞的制备主要是通过慢病毒感染的方式实现的。病毒通过随机整合的方式将CAR序列插入到T细胞基因组中,使致瘤风险增加。此外,T细胞可能会对病毒来源的DNA产生特异免疫反应从而阻碍CAR的持续表达,而且病毒的工业化制备需要高昂的成本。现有方法无法同时解决使用病毒和随机插入这两大问题。因此,亟需开发新一代的CAR-T技术来更好地解决这些问题。
本研究成果是在全球首次利用CRISPR/Cas9基因编辑技术在PD1位点实现定点整合的CAR-T细胞产品,也是世界首例非病毒PD1定点整合CAR-T细胞治疗淋巴瘤的临床研究。研究结果表明,使用同源臂长度为800bp的线性双链DNA作为模板可以通过同源介导修复机制获得数量最多的CAR整合细胞;PD1-19bbz CAR-T细胞表现出更强大、更持久的杀伤效果,小鼠生存率得到显著提高;临床研究证明PD1-19bbz CAR-T细胞具有出色的临床安全性,且在患者体内可获得快速扩增和长时间的维持。在难治复发淋巴瘤患者中,客观缓解率高达100%,完全缓解率达到87.5%。PD1-19bbz CAR-T细胞产品中存在高比例的记忆性T细胞,体内PD1-19bbz CAR-T细胞具有更强的杀伤肿瘤作用,长期存续的CAR-T细胞具有记忆性细胞的特征。全面阐明了非病毒PD1定点整合CAR-T细胞优越的临床疗效背后的作用机制(图)。
该研究意味着全新CAR-T细胞技术平台的建立。CAR-T细胞在治疗难治复发淋巴瘤中表现出的高缓解率和低毒副反应的临床结果在全球处于领先水平,标志着中国学者在CAR-T细胞研发及临床转化应用领域的新突破。