| |
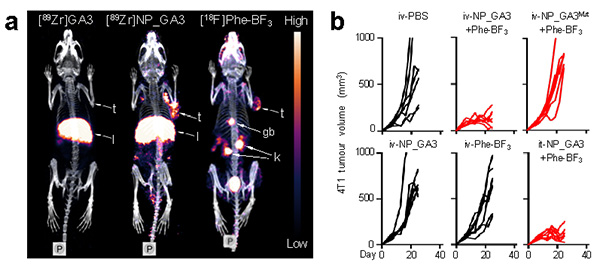 |
a. PET-CT分子影像在活体内示踪“双靶向”生物正交剪切系统b. 硼氨酸介导的生物正交剪切系统可在肿瘤内选择性释放Gasdermin焦亡蛋白,在动物模型上显著抑制肿瘤生长
图 硼氨酸介导的生物正交剪切系统的分子影像及Gasdermin蛋白调控
在国家自然科学基金项目(批准号:U1867209、21778003、81788104)等资助下,北京大学刘志博课题组与北京生命科学研究所邵峰实验室合作,通过新型生物正交体系首次揭示了细胞焦亡的抗肿瘤免疫功能。研究成果以“一个生物正交体系揭示了细胞焦亡的抗肿瘤免疫功能(A bioorthogonal system reveals antitumour immune function of pyroptosis)”为题,于2020年3月11日在线发表在《自然》(Nature)上,论文链接为:https://www.nature.com/articles/s41586-020-2079-1。
肿瘤免疫在癌症治疗中发挥着愈加重要的作用,但其作用位置、引发机制及作用蛋白的相互关系错综复杂。因此,实现“在且仅在”肿瘤上进行目标蛋白的功能调控,是对目标蛋白在肿瘤免疫过程中进行表型-功能-机理研究的有力工具和必要条件。刘志博课题组结合B-10可吸收热中子产生α离子的物理特性,将硼氨酸用于放射性分子影像引导的硼中子俘获治疗(BNCT)中。硼氨酸上的三氟化硼基团可直接用于硅烷的脱除反应,赋予18F-硼氨酸探针激活的功能(Probing-to-Perturbing),并在细胞以及活体水平上构建了硼氨酸介导的生物正交剪切系统。利用北京大学自产的Zr-89放射性核素,结合PET分子影像,实验发现18F-硼氨酸主要在肿瘤和肾脏富集,而Zr-89标记的蛋白载体和抗体前药主要在肿瘤和肝脏富集(图a),两者仅在肿瘤处相遇,从而实现了“在且仅在”肿瘤内的定点蛋白调控及药物释放。该正交剪切系统具有普适性,对需要在肿瘤细胞内选择性释放的蛋白更具优势。通过与邵峰实验室合作,将该“双靶向”生物正交系统应用到Gasdermin蛋白调控及药物释放研究中,实现了肿瘤上原位可控性地激活细胞焦亡,从而对肿瘤进行了清除(图b)。
该研究工作展现了放射性分子影像导航的“双靶向”生物正交剪切系统效率高、肿瘤靶向性好的优势,同时该研究也展现了将分子探针改造为激活剂(Probing-to-Perturbing)在体内可控释放上的巨大潜力,为蛋白偶联药物等前药及载药体系的发展提供了新方向。