在国家自然科学基金项目(项目编号:91432108、31225010、 81527901、81600954、81701335、81730035)等资助下,浙江大学医学院和求是高等研究院胡海岚团队在抑郁症研究方面取得重大进展。研究成果以“Ketamine Blocks Bursting in the Lateral Habenula to Rapidly Relieve Depression”(氯胺酮阻断外侧缰核簇状放电实现快速抗抑郁)和“Astroglial Kir4.1 in the Lateral Habenula Drives Neuronal Bursts in Depression”(星形胶质细胞中Kir4.1驱动外侧缰核神经元簇状放电介导抑郁症发生)为题,于2018年2月15日,在Nature(《自然》)上以同期两篇研究长文(Research Article)方式在线发表,论文链接分别为:https://www.nature.com/articles/nature25509和https://www.nature.com/articles/nature25752。Nature(《自然》),Science(《科学》), Nature Reviews Neuroscience(《自然评论·神经科学》), Scientific American(《科学美国人》)等主流学术杂志都进行了长篇报道评论。
现代社会,抑郁症已成为影响人类生活最严重的精神疾病之一,全球发病率达11%,抗抑郁药物的销售额每年以百亿美金计。传统的理论认为,大脑中单胺类递质的减少引起了抑郁症。目前的抗抑郁药物大都基于该理论来提高全脑单胺类递质的浓度。但这类药物起效时间缓慢,需要几周甚至几个月。而且只在20~30%左右的病人中起效。近年来科学界发现氯胺酮在低浓度下可以在一小时内快速地改善情绪,并且消除严重抑郁患者的自杀想法。可在70%以上的难治性抑郁症患者中发挥作用,因此被称为“整个精神疾病领域近半个世纪最重要的发现”,但氯胺酮的快速抗抑郁机制一直未被阐明。
胡海岚教授团队首次揭示了外侧缰核的簇状放电是抑郁症发生的充分条件,氯胺酮通过阻断外侧缰核簇状放电,产生快速抗抑郁效果。胡海岚团队发现,在多种抑郁动物模型中,外侧缰核神经元自发簇状放电活动都显著增高,且表现出θ波同步化。外侧缰核簇状放电依赖于大脑中N-甲基-D-天冬氨酸受体(NMDAR),而氯胺酮作为NMDAR的阻断剂,能完全阻断外侧缰核神经元的簇状放电。通过套管将氯胺酮局部给药于外侧缰核,能快速缓解动物的多种抑郁症状。通过光激活外侧缰核中表达的光敏感通道诱发簇状放电,可引起典型的抑郁行为。利用脑片电生理和数学建模的方法进一步证明,外侧缰核的簇状放电除了依赖NMDAR,还需要神经元膜电位的超极化和低电位敏感的T型钙通道(T-VSCCs)协同发挥作用。在外侧缰核内局部阻断T-VSCCs同样产生了快速的抗抑郁效果。这一系列研究阐明了氯胺酮快速抗抑郁的全新神经机制——即氯胺酮可以通过阻断外侧缰核的NMDAR和T-VSCCs依赖的簇状放电,进而释放对下游单胺类奖赏脑区的过度抑制,最终产生快速抗抑郁的疗效。
胡海岚教授团队进一步探索了导致外侧缰核神经元超极化和簇状放电活动增加的分子机制。高通量蛋白质谱筛选发现内向整流型钾通道Kir4.1,在抑郁动物的缰核中显著增多。在外侧缰核星形胶质细胞中过表达Kir4.1引起抑郁样行为。利用RNA干扰或显性失活突变,在外侧缰核中特异地降低星形胶质细胞Kir4.1的表达水平或阻断其功能,均能有效缓解抑郁症状。利用免疫荧光和免疫电镜技术,发现外侧缰核中Kir4.1表达的星形胶质细胞的突起紧密地包裹在神经元胞体的周围,脑片电生理和数学建模进一步证明Kir4.1可能通过调节狭小胞外空间的钾离子浓度,调节神经元的放电模式。该研究阐明了一种全新的抑郁症发病的分子机制——即外侧缰核神经元和胶质细胞的交互作用发生改变,从而引发神经元的簇状放电,最终介导抑郁行为。
胡海岚教授团队的系列研究成果不仅解释了抑郁症外侧缰核簇状放电增加的分子机制,同时揭示了抑制这种簇状放电作为快速抗抑郁靶点的有效性,形成有机的整体,从分子、细胞到神经环路的尺度,揭示了抑郁症和新型抗抑郁药物的机制,并为开发新型的快速抗抑郁药物提供了多个崭新的分子靶点。
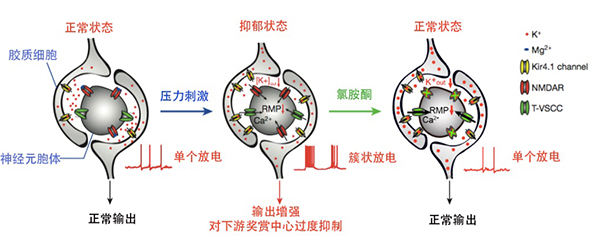
图. 外侧缰核簇状放电与抑郁状态的调控