在国家自然科学基金项目(项目编号:31200798)等资助下,清华大学医学院沈沁课题组在神经干细胞干性维持的分子机制方面取得重要进展,相关研究成果以“Persistent expression of VCAM1 in radial glial cells is required for the embryonic origin of postnatal neural stem cells”(VCAM1在放射状胶质细胞中的持续表达是神经干细胞从胚胎维持到成年的必要条件)为题,于2017年7月19日以封面及亮点文章(featured article)的形式发表在Neuron上。论文链接:http://www.cell.com/neuron/fulltext/S0896-6273(17)30599-8。
神经干细胞发育和干性(神经发生能力)维持不仅与神经系统发育性疾病有关,还与阿尔茨海默病、帕金森病等神经退行性疾病的发生和发展密切相关,是神经科学领域备受关注的研究热点之一。在哺乳动物大脑发育时期,神经干细胞广泛存在于胚胎神经系统的脑室区(ventricular zone,VZ),神经干细胞通过分化产生神经元(neurogenesis)和神经胶质细胞(gliogenesis)并形成网络连接,从而构建具有复杂结构和功能的大脑。而在成年时期,神经干细胞主要局限在两个区域:侧脑室的脑室下区(subventricular zone,SVZ)和海马齿状回的颗粒层下区(subgranular zone,SGZ),并且终生具有成体神经发生(adult neurogenesis)的能力,对神经细胞损伤修复具有重要意义。
针对神经干细胞干性维持的分子调控机制,沈沁课题组首次发现:血管细胞粘附分子-1(vascular cell adhesion molecule 1,VCAM1)在小鼠端脑中的表达模式与神经干细胞的发育进程相一致。先是广泛存在于脑室区的放射状胶质细胞(radial glial cell,RGC)即胚胎期的神经干细胞中,然后逐步富集表达于缓慢增殖的前成体神经干细胞,并在成体静息神经干细胞中持续表达。若在胚胎时期敲除VCAM1或突变VCAM1的胞内段,则会导致神经干细胞提前退出细胞周期、更早地分化消耗掉,导致成体神经干细胞数目的减少以及成体SVZ损伤后增生修复能力的下降。反之,若将VCAM1在神经干细胞中持续表达,则可使更多的神经干细胞维持增殖分化能力到出生后和成年时期。其可能的分子机制是,在胚胎发育的早期,VCAM1在背侧和腹侧端脑会通过抑制糖原合成酶激酶(GSK3β)、维持链蛋白(β-Catenin)信号通路的活性,促使神经干细胞处于活跃的增殖分化状态;而在胚胎发育的中晚期,腹侧端脑的VCAM1会通过GSK3β非依赖途径,抑制β-Catenin信号通路的活性,使神经干细胞处于不活跃的状态,进而使持续表达VCAM1的细胞亚群进入极缓慢增殖、分化的静息状态,最终成为成体干细胞。该研究提示,VCAM1在时间与空间上的特异表达及其与β-Catenin信号通路的不同作用,对于神经干细胞的发育起着重要作用;而VCAM1在神经干细胞亚群中的持续表达则是成体神经干细胞干性维持的必要条件之一。
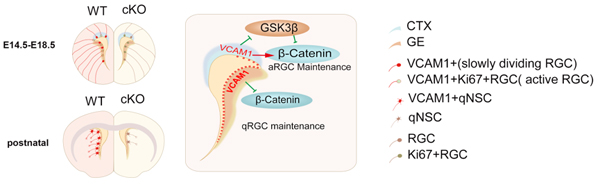
图. 与野生型(WT)小鼠对比,VCAM1敲除(cKO)的小鼠在胚胎期和出生后的神经干细胞(RGC和qNSC)均减少