编者按
随着经济发展和人民生活水平的提高,饮食结构和环境因素发生着改变,我国心脑血管疾病的发病率呈逐年上升趋势,已成为危害国民健康的“头号杀手”。
我国科学家立足基础科学研究前沿,在“血管稳态与重构的调控机制”领域以国家自然科学基金重大研究计划形式予以立项,启动了为期8年的连续资助。
该重大研究计划实施以来,研究者们取得多项重要进展,在医学、生物学和材料学等领域,特别是心血管领域最具影响力的国际学术期刊上发表了一系列高水平论文,极大地推动了学科的快速发展,有力地提升了我国在血管稳态研究领域的国际影响力。
如今,“中国声音”正在被世界听到,“中国方案”正在被国际同行学习推广。

朱毅在学术交流会上发言。
■本报记者张楠
“稳”,是近年来人们工作和生活中的一个关键词,“稳了”这一网络热词更是传递着胜券在握的信心。在科学家眼中,一个机体所有的生理功能,就是为了保持自身处于动态平衡的生理状态,也就是稳态。
在更小的尺度上,血管稳态平衡在维持机体的正常生理功能中发挥着重要作用。
2014年,国家自然科学基金重大研究计划“血管稳态与重构的调控机制”正式启动。该重大研究计划以解决重大血管疾病具有共性的前沿科学问题为导向,以血管稳态与重构的调控机制的基础研究为中心,充分发挥医学、生命科学和信息科学等学科交叉的优势,取得了系列重要成果。
在科学家们看来,当下这一领域的探索刚刚踏上征程。他们期待通过顶层设计和科研攻关,推动血管相关疾病发病率、死亡率的“拐点”早日出现。
科学目标:反复凝练
实施一项重大研究计划,势必要有准确的目标指引。
该重大研究计划专家组组长、天津医科大学教授朱毅告诉《中国科学报》,在该计划正式启动的3年前,如何界定其科学目标已经在酝酿。
2010年10月,在一个心血管研究论坛的间隙,朱毅等几位领域内专家与来自国家自然科学基金委员会(以下简称自然科学基金委)的管理人员讨论起领域内的学术话题。
最终,大家的观点是:如何提高心脑血管病的诊治和预防水平,已成为迫切需要解决的重大医学和社会问题,开展相关机制机理研究意义重大。但相关研究要进一步聚焦,是在心脏还是血管领域呢?
为了解答这次讨论留下的问题,他们组织力量调研了国内心血管研究团队情况,考量每年申请的心血管研究项目分布,发现血管研究队伍更大、相对更成熟、申请项目更多。朱毅认为:“这说明我国的血管研究基础更好。”
基于此,2011年6月,自然科学基金委医学部组织召开研讨会,与会60多位专家提出了“血管功能调控与血管病变”的研究目标,并于同年9月提交自然科学基金委。但是,当时同行专家们认为,项目的科学问题还不够聚焦。
于是,在当年12月召开的双清论坛上,参会专家再次深入研讨该重大研究计划的科学目标,提出了“重构”的概念,凝练出“血管稳态与重构的调控网络和关键节点”这一核心科学问题。
朱毅进一步解释说:“稳态,英文是homeostasis,是生理学最重要的概念,指机体所有的生理功能调节其内环境的组分、特性达到的动态平衡。冠心病、高血压、脑卒中、肺动脉高压等心脑血管疾病的关键病理学基础,正是血管功能失衡及损伤修复异常引起的血管重构。”
经过前期大量准备工作和顶层设计,2014年“血管稳态与重构的调控机制”重大研究计划正式启动,总体科学目标包括阐明血管结构与功能稳态以及疾病过程中重构的关键信号通路和网络模式,揭示与血管重构相关的重大疾病的发病机制,以及寻找疾病早期诊断和疾病转归的预警标志等。
学科交叉:共同跨越
“在执行过程中,我们做了一些工作,希望让其他学科领域更多的优秀科学家参与进来,共同实现跨越式发展。”朱毅口中的“一些工作”,是专家组8年来一以贯之的对该重大研究计划的专业指导和把关。
血管稳态是医学领域的前沿学科,是心脑血管疾病及其他系统急、慢性疾病的病理生理学共性问题。
代谢、氧化应激、炎症、内源性生物活性物质、遗传和表观遗传调控等众多学科前沿热点问题,直接涉及正常血管功能与结构的维持,以及血管损伤与修复引起的血管重构。
而阐明血管稳态失衡导致血管结构和功能的改变以及参与心血管疾病的发生发展机制,需要将医学、生物学、化学、材料学、影像学和信息科学等多学科交叉融通,充分应用最新的前沿技术和方法。
该重大研究计划支持的研究涉及基因编辑、干细胞、治疗性疫苗、材料科学、生物光电等相关领域。
为保证支持项目的前沿性与创新性,该重大研究计划在实施过程中,每年举办一次交流会召集项目负责人进行项目汇报。借此机会,专家组每次邀请2至3位系统生物学、化学、光学、细胞生物学、免疫学、药学等不同领域的优秀学者参会,并分别就生物信息网络分析、纳米技术、单细胞测序分析、分子免疫学、生物医学光子学等学科新进展作报告。
“项目外的专家能从中了解我们的研究内容,我们也能获得更多跨学科的启发。”朱毅介绍,曾被邀请来交流会作报告的神经学家、中国科学院院士骆清铭以及研究单细胞测序的优秀学者刘兵,此前都未曾涉及血管研究,后来他们的团队参加了该重大研究计划中的集成项目。
南京医科大学教授陈绍良因从血流剪切力角度创造新的支架植入术而享有国际声誉。作为心内科临床医生,他加入该重大研究计划后与基础领域科研人员深入合作,实现了多项科研成果的临床应用,为该重大研究计划推进作出重要贡献。
“我们特别注重鼓励临床、基础以及其他学科的研究人员组织多学科交叉的团队进行项目申报,针对血管稳态与重构相关疾病的机制、诊断、预防和治疗进行合作攻关。”朱毅表示。
该重大研究计划在血管免疫调控、血管细胞命运转归、血管微环境、血管力学生物学机制以及动脉粥样硬化、肺动脉高压、主动脉瘤等重大血管疾病的防治新技术方面布局了13个集成项目。
项目承担人不仅包括我国心血管、脑血管等血管稳态相关领域的知名学者,还吸引了多名从事影像学、生物材料与生物工程、生物信息学等交叉学科研究的优秀科学家。
通过培育、重点支持和集成3种项目类型的资助布局,该重大研究计划解决了领域内多个重要科学问题和“卡脖子”技术难题,培育了一批学科交叉的转化医学创新研究团队,同时建立了科学合理的学科布局模式。
项目收获:走上世界舞台
经过8年的实施,该重大研究计划对血管稳态及失衡科学领域的发展、新理论的提出和人才的培养都作出了重要贡献。
针对与血管稳态与重构相关的重大国际科学前沿问题,科研人员开展血管稳态的调控网络和关键节点挖掘、血管稳态到失衡的分子机制研究;面向治疗血管稳态相关疾病的重大需求,他们在疾病预警和防治的新方法、新技术和新模型等方面取得了重要进展和创新性成果。
截至2022年8月,该重大研究计划共发表SCI研究论文上千篇,平均影响因子超过7,一批高水平的工作成果发表于《自然》《科学》《细胞》等期刊。
在该重大研究计划实施过程中,有3个团队获国家自然科学奖二等奖和国家科学技术进步奖二等奖,数十位承担项目的学者进入国际重要学术组织和核心期刊任职。
2019年,国际心脏研究会(ISHR)世界大会首次落地中国,朱毅为大会主席。
“中国的声音,已经被世界听到。”说起研究实力的提升、研究队伍的成长,朱毅难掩激动。这一直是该重大研究计划专家组所重视和着力的方面。
中国学者的身影已经走上该领域的世界舞台。中国科学院分子细胞科学卓越创新中心研究员周斌获ISHR“杰出研究员奖”,中山大学医学院高血压研究所教授杨天新获美国高血压协会“Lewis K. Dahl Memorial Lecture奖”,首都医科大学附属北京安贞医院研究员杜杰获美国心脏协会(AHA)“ATVB特别成就奖”。
在2017年美国经导管心血管治疗学术会议(TCT 2017)主会场,陈绍良携团队进行PADN微创治疗肺动脉高压的视频直播,首次面向全球现场演示这一原创技术。
华中科技大学同济医学院附属同济医院教授汪道文基于炎症导致血管稳态失衡的关键发现开创的治疗暴发性心肌炎的“中国方案”,同样在国际上产生了重大反响,并被国际同行学习推广。
该重大研究计划执行期间,项目负责人入选各类人才计划60余项,其中1人当选中国科学院院士。
“由项目凝聚起来的研究团队还将在未来持续发挥协同创新优势,取得更多重要原创性研究成果。”朱毅对此很有信心。
展望:未来可期
血管功能的自稳态平衡是机体生命活动的重要组成部分。在从事这一领域研究的科学家看来,科研工作好比机体的生命活动,其良性发展离不开稳定的科研生态。
该重大研究计划实施8年来,学者们与自然科学基金委一直坚定维护着公平、公正、公开的学术环境。
该重大研究计划实施期间,随着新的遗传示踪、基因编辑方法的发明,以多组学为基础的大数据时代的到来,以及新型生物材料的不断涌现,专家组对于复杂疾病的认识也在不断深入,对该重大研究计划的后期布局进行了动态调整,加快了对重大血管重构性疾病发生发展分子机制的深入研究。
如今,该重大研究计划已圆满结束,但学者们仍然感到自己刚刚踏上征程。
“我国的现状是血管相关疾病发病率、死亡率仍居高不下,而医疗设备、药物和指南都过度依赖国外,说明我们医学科技的创新能力还不足。”面向世界科技前沿、面向人民生命健康,朱毅希望,有更长期和更大力度的资金投入支持预防-基础-临床-转化研究协调发展,推动血管相关疾病发病率、死亡率的“拐点”早日出现。
《中国科学报》 (2023-04-24 第4版 自然科学基金)
精准示踪!“看清”血管发育过程
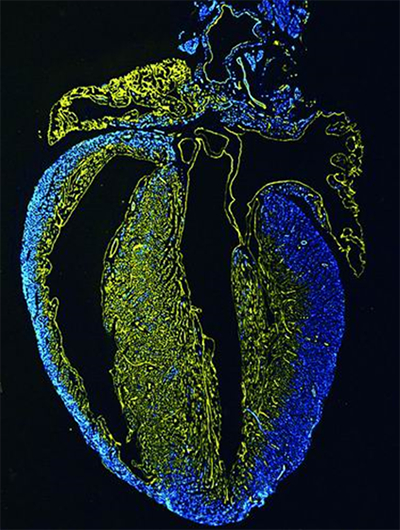
哺乳动物小鼠冠状动脉有两个不同的发育起源。
心肌梗死是临床上常见的心血管疾病,具有极高的致死、致残率。其病因主要是给心脏供血的冠状动脉发生梗阻后,导致大片心肌细胞死亡,而死亡的心肌细胞基本无法再生。为治疗心肌梗死,医学领域逐渐形成两条研究思路,即产生新的血管以增加心脏供血和直接产生新的心肌细胞。那么,它们在体内来源于哪里,又是如何产生的?
围绕这些科学问题,在国家自然科学基金重大研究计划“血管稳态与重构的调控机制”支持下,中国科学院分子细胞科学卓越创新中心研究员周斌带领团队开发了多种遗传示踪工具,对心血管细胞的发育起源进行了探索,取得一系列重要进展。
周斌介绍,目前研究细胞命运主要采用“细胞示踪技术”,其原理是通过遗传改造在某种细胞中表达一种来自噬菌体的Cre重组酶。Cre酶可以特异性识别一段DNA序列(即loxP位点)发生同源重组反应,从而实现对特定细胞的遗传标记。由于这种标记是在DNA水平上,所以无论被标记的细胞是否发生命运变化,这种标记都是永久性的。
“有了这一工具,我们就可以研究冠状血管或心肌细胞的来源,观察体内细胞的分化或增殖过程。”周斌表示。
传统观点认为,胚胎时期冠状动脉已经形成,而出生后的冠状动脉是由胚胎早期形成的冠状动脉扩增而来。利用新的细胞示踪技术,周斌团队发现,出生后很大一部分冠状动脉由心内膜细胞分化而来,这提示心内膜细胞是心梗后血管再生治疗的潜在靶点。这项工作于2014年发表在《科学》上,并入选2014年中国科学十大进展。
该团队的另一项工作围绕长期存在的心脏干细胞争议展开。他们发现,哈佛大学医学院Piero Anversa团队曾报道c-Kit+干细胞能形成心肌细胞的证据存疑。“在体内,c-Kit+不仅在干细胞中表达,也在少量心肌细胞中表达,这可能导致示踪结果出现假阳性。”周斌说。
该团队利用新重组酶Dre,结合Cre-loxP建立双重组酶系统,实现体内细胞的精准示踪,解决了造成假阳性的非特异性标记问题。由此,他们严谨地证明了成体哺乳动物体内新的心肌细胞是由原有的心肌细胞增殖而来,而不是由心脏干细胞分化而来。这项工作2018年发表在《循环》上,解决了心脏干细胞研究近20年的重大争议问题,为心血管领域开辟了新的研究方向。
该团队还发展了双重组酶介导的细胞增殖示踪技术、创立邻近细胞示踪技术等。其系统性研究工作突破了细胞示踪技术的时空精度极限,实现了对血管稳态与重构理论的精准认知。
《中国科学报》 (2023-04-24 第4版 自然科学基金)
新研究表明血流模式与血管早期病变相关
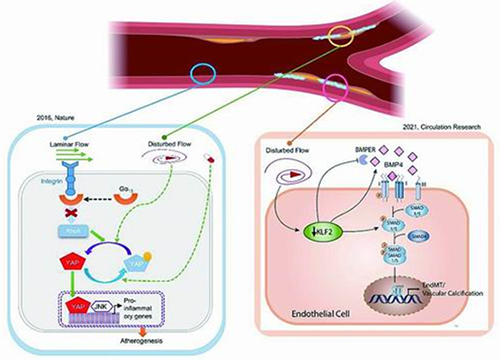
血流剪切力通过激活内皮细胞机械感应器相关信号通路调节内皮功能。
动脉粥样硬化是冠心病、脑梗死、外周血管病的主要原因。医学上已经认识到,斑块易出现在动脉弯曲和分岔处,不同的血流剪切力可通过调节血管内皮细胞功能影响血管的稳态。其中,层流具有维持内皮功能稳态与抗动脉粥样硬化的作用,而湍流可以激活内皮,具有促动脉粥样硬化的作用。然而,血流如何影响斑块形成,在科学上仍是不完全清楚的问题。
在国家自然科学基金重大研究计划“血管稳态与重构的调控机制”支持下,香港中文大学深圳研究院教授黄聿带领团队围绕血流模式如何导致血管早期病变的问题开展了研究。
黄聿向《中国科学报》介绍,血流剪切力通过激活内皮细胞机械感应器相关信号通路调节内皮功能。因此,找到相关的信号通路和作用原理,是揭开血管早期病变之谜的一把钥匙。
研究发现,Hippo通路在血管稳态维持中发挥重要作用。Hippo-YAP信号通路是新发现的血流剪切力的感应器。层流通过激活Hippo通路抑制转录因子YAP/TAZ的活性,从而维持内皮稳态抑制动脉粥样硬化。
进一步研究则表明,内皮细胞Hippo信号通路的上游激酶MST1能抑制湍流导致内皮激活和动脉粥样硬化,降脂他汀类药物可有效抑制内皮细胞的YAP/TAZ活性,为探索治疗动脉粥样硬化血管疾病开辟了新方向。
基于这一研究结果,课题组提出动脉粥样硬化早期发生的新理论,相关信号通路有望成为对抗动脉粥样硬化的新药物靶点。这项工作2016年在《自然》发表。黄聿团队利用药物筛选平台,发现了能模拟层流对细胞基因表达影响的化合物牡荆素,并利用动物模型证明了牡荆素具有抗炎和抗粥样硬化活性。
同时,黄聿团队还揭示了血流剪切力在血管钙化中发挥的重要作用。据了解,作为动脉粥样硬化、糖尿病、高血压和慢性肾病等疾病的常见血管并发症,血管钙化是羟磷灰石矿物质沉积于血管壁的病理过程。研究发现血流敏感性因子KLF2可以抑制血管钙化病理变化发生,首次揭示了阻止血管钙化的保护因子,为血管钙化的治疗提供了新靶点。
《中国科学报》 (2023-04-24 第4版 自然科学基金)
改良血管“土壤”,治疗动脉粥样硬化有新方
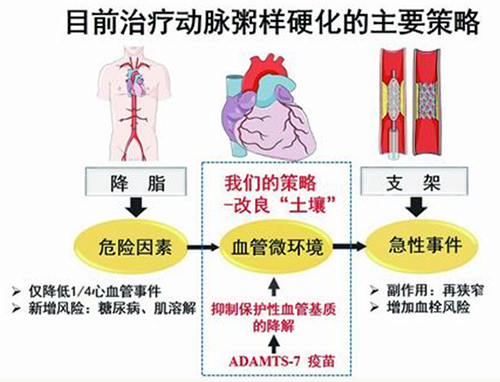
新研究通过改良血管微环境应对动脉粥样硬化。
近百年来,科学家对动脉粥样硬化发病机制的认识主要集中在高脂血症学说。目前临床上针对动脉粥样硬化相关的冠心病和脑卒中的主要防治手段就是降血脂。
然而,在实际的临床应用中,降脂药物仅阻止了不到1/3心血管事件的发生,还有大量人群即使血脂控制达标,依然会出现心梗、脑卒中等不良心血管事件。科学家认识到,应对动脉粥样硬化,除了降血脂外,急需理论创新和临床实践的突破。
在国家自然科学基金重大研究计划“血管稳态与重构的调控机制”支持下,北京大学医学部教授孔炜带领团队从血管微环境入手,深入研究其理化特征与变化规律、调控网络与关键节点等科学问题。研究证明,改善血管的“土壤”,可为动脉粥样硬化治疗方案提供降脂以外的新思路。
除血脂等危险因素外,血管壁本身的微环境及其所形成的“土壤”对动脉粥样硬化发展也发挥重要作用。
作为血管中比例最大的组成成分,细胞外基质由胶原、弹力纤维、糖蛋白和蛋白多糖等共同形成稳定的细胞外微环境,其成分和功能具有独特的理化特征,始终处于动态变化中,是胞外生物化学与生物力学刺激作用于细胞膜上受体的“桥梁”。孔炜团队从基质生物学出发,围绕其组成和降解、功能、相互作用蛋白、信号传导和调控机制完成一系列原创性工作。
该团队发现了多个维持血管稳态的关键基质蛋白,包括基质蛋白COMP、TSP-1、Nidogen2等,揭示其相互作用蛋白及其在动脉粥样硬化相关血管病变中的保护作用。
他们进一步克隆了COMP的水解酶ADAMTS-7,证实ADAMTS-7可以通过改变血管壁基质成分,以降脂非依赖的方式促进动脉粥样硬化及血管损伤后再狭窄。
一项包含4万例冠心病人数据的遗传学研究证实“ADAMTS-7是人类冠心病易感基因”,有评述称“ADAMTS-7是被基础研究和人群研究共同验证的重要心血管靶点”。
最近,该团队成功设计出国际首个降脂非依赖的动脉粥样硬化疫苗ADAMTS-7疫苗。通过多种动物模型,研究证实了其在不影响血脂的情况下,可以显著抑制动脉粥样硬化和新生内膜的发生发展。
(本版文章除署名外为本报记者甘晓采写,本版图片均由研究团队提供)
《中国科学报》 (2023-04-24 第4版 自然科学基金)