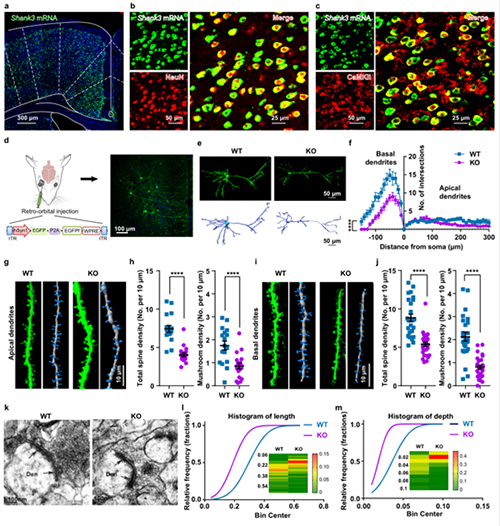
图1 Shank3缺失自闭症小鼠前扣带回皮质锥体神经元突触结构出现异常

图2 2019年8月Nature Neuroscience的封面,图中描绘了三只小鼠试图拯救一只孤独地待在星星上的自闭症小鼠,三只小鼠通过三个高亮的字母“A-C-C”(前扣带回皮质)连接在一起,寓意可通过兴奋ACC可以改善自闭症小鼠的社交障碍
(Nature Neuroscience杂志为研究配发的封面图片)
在国家自然科学基金重点项目(批准号:81730035)、面上项目(批准号:81771476,81371498)等资助下,第四军医大学武胜昔教授、王文挺副教授团队与美国麻省理工学院冯国平教授等团队开展合作研究,在自闭症社交障碍的发病机制方面取得重要进展。相关结果以“Anterior Cingulate Cortex Dysfunction Underlies Social Deficits in Shank3 Mutant Mice”(前扣带回皮质功能异常介导Shank3缺失小鼠的社交障碍)为题,发表在2019年8月的Nature Neuroscience(《自然·神经科学》)杂志上,并被选为该期杂志的封面文章。第四军医大学郭保霖博士、陈晶博士,美国麻省理工学院陈迁博士为文章的并列第一作者,武胜昔教授、王文挺副教授及冯国平教授为通讯作者。论文链接:https://www.nature.com/articles/s41593-019-0445-9。
自闭症是目前备受关注的儿童精神疾病,发病率高达1%,其核心症状是社交障碍及重复刻板行为,但是发病机制不清,临床治疗手段缺乏。因此揭示自闭症核心症状的发病机制,研发有效的干预技术迫在眉睫。
该研究团队聚焦儿童自闭症社交障碍的发病机制这一“黑箱”,综合采用了Shank3缺失自闭症小鼠模型、稀疏病毒标记、电生理学、光遗传学等多种神经科学研究技术,证实了在Shank3缺失自闭症小鼠的前扣带回皮质(ACC)锥体神经元出现了兴奋性突触结构和功能损伤,导致这些神经元的传出活动减少,进而证实该自闭症小鼠的社交接触时间减少与ACC锥体神经元的活动降低有关。采用光遗传学技术,化学遗传学,药物局部注射等多种手段,发现提高Shank3敲除小鼠ACC锥体神经元的电活动或者兴奋性突触传递功能,自闭症小鼠的社交障碍得到明显改善。
本研究不仅揭示了ACC是自闭症社交障碍的关键靶区,而且发现了社交障碍的兴奋性突触结构及功能异常机制,为阐明自闭症社交障碍的发病机制及建立有效的临床治疗策略提供了科学的实验依据。