|
—— 第二部分 国家自然科学基金项目成果巡礼 ——

北京生命科学研究所的邵峰课题组,在国家杰出青年科学基金项目及其他项目的支持下,经过多年努力探索,鉴定出细菌内毒素和一类作用于宿主小G蛋白毒素的胞内天然免疫受体,该系列研究成果于2014年6月11日和8月6日在Nature上发表。研究团队成员均为邵峰组的博士研究生和博士后,主要包括石建金,赵越,徐浩,杨杰凌,王宇鹏,高文清等。研究得到了所内质谱中心陈涉博士和转基因中心王凤超博士的大力支持。
天然免疫对机体抗感染以及自炎症和自免疫疾病的发生至关重要,其核心是识别不同病原模式分子的模式识别受体(PRR),鉴定PRR蛋白并阐明其功能一直是免疫学研究的前沿。对于抗细菌免疫,此前的研究主要集中在细胞膜上的受体,而对于进入胞内的细菌被什么样的PRR所识别以及如何识别了解甚少。邵峰实验室一直专注于该方向的研究,在2011年的研究中,他们首次鉴定出NAIP家族的PRR蛋白作为受体直接识别细菌鞭毛素蛋白,同时也能识别存在于一大类致病菌中的毒力因子分泌系统的组成蛋白,诱导抗细菌炎症小体(inflammasome)通路的激活(Zhao et al., Nature 2011),这是首次实验证明存在识别细菌的胞内免疫受体。
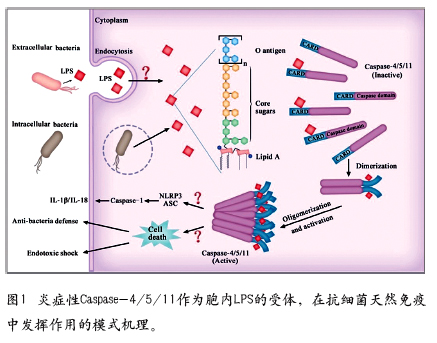
内毒素(LPS)是革兰氏阴性菌细胞壁的主要成分,也可诱导严重免疫反应,是败血症最主要的诱因。Bruce Beutler等人于上世纪90年代鉴定出Toll样受体4为LPS的膜上受体,获得2011年诺贝尔生理医学奖。最近在小鼠细胞中的研究表明进入胞内的LPS可诱导非经典炎症小体通路激活,导致细胞炎性坏死。但胞内LPS如何被识别以及人的细胞是否也能感知胞内LPS则完全不清楚。邵峰课题组的研究发现人和小鼠的炎症性Caspase-4/5/11为胞内LPS的受体,在结合LPS后发生寡聚化而激活,导致细胞炎性坏死(图1)。该研究鉴定出了最为重要的、识别胞内菌的免疫受体,使得开发败血症药物成为可能,同时也对理解Caspase家族蛋白的激活机制有很大概念突破。
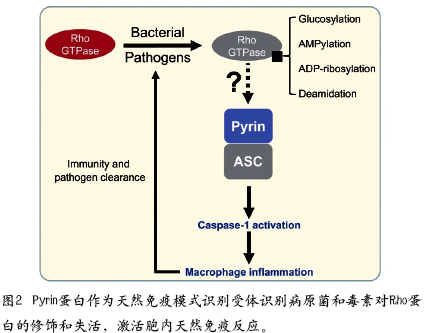
另外,修饰Rho家族小G蛋白是诸多病原菌为控制细胞骨架和抑制吞噬经常采用的机制,已有多种修饰Rho蛋白的细菌毒素报道,它们通过不同的化学修饰失活Rho蛋白,其中最为经典的就是来自艰难梭菌的TcdB,它对Rho进行糖基化修饰,是该菌诱导院内感染引起严重腹泻和伪膜性肠炎最主要的致病因子。邵峰团队研究发现包括TcdB在内的已知修饰和失活Rho蛋白的毒素,都可以被巨噬细胞所感知,进而介导经典炎症小体的组装和激活,启动抗细菌炎症反应。他们进一步发现Pyrin蛋白(遗传突变导致家族性地中海热自炎症疾病)为感受病原菌和毒素对Rho蛋白修饰的PRR蛋白(图2)。该成果不仅首次阐明了家族性地中海热疾病蛋白Pyrin的正常生理功能,并且也揭示了天然免疫系统对致病细菌特异性识别的一个重要机制。
邵峰实验室的上述三项研究成果,奠定了天然免疫系统识别胞内细菌以及区分致病菌和非致病菌的基本理论框架,是该领域里程碑性的发现,也是中国科学家对免疫学发展做出的重要贡献。
|
