|
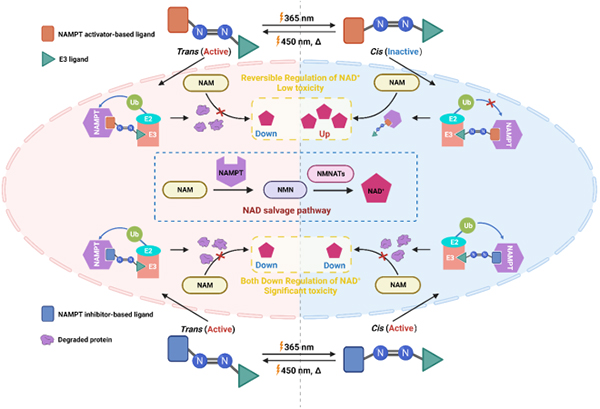 |
图 基于激动剂的光控NAMPT PROTAC实现NAMPT和NAD+的可逆时空调节
在国家自然科学基金项目(批准号:82030105、82273779)等资助下,海军军医大学盛春泉教授课题组在光控蛋白降解靶向嵌合体(PROTAC)领域取得进展。研究成果以“光控PROTACs实现NAMPT和NAD+的可逆时空调节(Photoswitchable PROTACs for reversible and spatiotemporal regulation of NAMPT and NAD+)”为题,于2024年1月28日在《德国应用化学》(Angewandte Chemie International Edition)上在线发表。论文链接:https://doi.org/10.1002/anie.202315997。
烟酰胺腺嘌呤二核苷酸(NAD+)是一种重要的辅酶,广泛参与细胞代谢和信号转导。烟酰胺磷酸核糖转移酶(NAMPT)是哺乳动物体内NAD+生物合成途径中的关键限速酶,调控细胞内NAD+稳态。研究发现,NAD+上调与肿瘤发生发展密切相关,抑制肿瘤细胞NAD+合成具有显著抗肿瘤效果;同时,NAD+对于维持正常细胞功能必不可少,NAD+缺乏会导致多种疾病,包括代谢疾病、衰老和神经退行性疾病等。尽管NAD+在生理和病理条件下发挥着重要作用,但目前尚缺乏有效的化学工具来实现对NAD+的精准时空调节,限制了对NAD+功能的深入理解。
蛋白降解靶向嵌合体(PROTAC)是一种双功能小分子化合物,它利用细胞内的泛素-蛋白酶体途径降解靶蛋白。PROTAC通过“事件驱动”的模式,以低剂量、高选择性、靶向不可成药靶点等优势成为药物研发的热门领域。然而,PROTAC的组织选择性差,对正常细胞的蛋白降解易导致毒副作用。光控-PROTAC可以实现靶蛋白降解的时空激活,但还存在诸多瓶颈问题。现有技术只能通过紫外光在细胞水平调控降解活性,无法实现在动物体内的光控调节。此外,PROTAC通常以高活性抑制剂作为靶蛋白配体,当通过光去活化时,光控-PROTAC仍对靶蛋白具有显著的抑制作用,无法实现对靶蛋白功能的正反调节。
为解决上述问题,该研究以NAMPT激动剂作为靶蛋白配体,将具有高转化率和双稳态的光控元件二甲基吡唑偶氮苯作为连接子,设计合成了一类新型光控NAMPT PROTAC(PS-PROTAC)分子。PS-PROTAC实现了靶蛋白上调和下调之间的光学调控,该分子经450 nm光照后处于反式构型,降解NAMPT,下调细胞内NAD+;经365 nm光照后处于顺式构型,对NAMPT无降解作用,发挥激动效应,上调细胞内NAD+。此外,通过增加光源功率和照射时间,620 nm长波同样能够促使PS-PROTAC从顺式变为反式,从而实现了在小鼠移植瘤模型抗肿瘤活性、NAMPT和NAD+稳态调节的光学操控(图)。
该研究设计了新型光控可逆调节NAMPT和NAD+的PROTAC分子,为体内精准调控蛋白降解提供了新的思路,也为NAD+的生物学功能研究及光药理学的应用提供了新的工具分子,有望为肿瘤等重大疾病的精准治疗提供新的策略。