快速止血的神奇胶水:华东理工大学朱麟勇团队取得光交联生物材料的新突破
稿件来源: 华东理工大学化学学院 | 作者:华东理工大学化学学院 | 摄影:华东理工大学化学学院 | 编辑:亦枫
5月14日,我校朱麟勇教授与浙江大学医学院欧阳宏伟教授课题组合作研发的,一种能够在数秒内完全止住大动脉损伤和心脏穿透伤大出血的仿生水凝胶材料,相关研究论文“一种超强组织粘附的水凝胶材料用于动脉和心脏破损的止血修复”(A strongly adhesive hemostatic hydrogel for the repair of arterial and heart bleeds)在线发表在Nature Communications杂志上。该成果一经报道便引发了英国每日邮报、NewScientist、BioArt、DeepTech等媒体的广泛关注,并称之为“神奇胶水”(A“miracle”glue),也有许多媒体称之为快速止血“黑科技”等。
这种名为“Hydrogel”的水凝胶材料的研发成功绝非偶然,背后是无数科研人员夜以继日的研究和付出。“神奇胶水”背后到底隐藏着怎样的“黑科技”?朱麟勇教授课题组近年来在光交联生物材料领域取得的一系列研究进展,或许是最好的解释。
自2007年进入华东理工大学组建课题组以来,朱麟勇始终带领团队聚焦于“光化学方法构建生物医用材料”的研究并已形成特色。
早在十年前,朱麟勇就注意到光交联生物材料在齿科修补取得了颠覆性成功,特别易于临床操作,几乎全面取代传统的银汞齐材料。他意识到,假若将该类技术拓展到软组织应用层面,光交联“易用”特性势必为诸如创面封闭、止血与修复等众多临床实际问题的解决提供创新手段。事实上,生物材料学界已经形成共识,具有最类似生物软组织的仿生水凝胶材料是软组织修复的利器。然而,传统一直沿用的自由基介导的光交联固化机制始终无法规避自由基带来生物毒性、氧阻聚使得薄层成胶困难等与生俱来的缺陷,所形成的水凝胶或“软而弱”或“硬而脆”,缺乏韧性,无法与潮湿、动态的组织表面粘附。这种现状导致光交联水凝胶生物材料在学术界发表了大量的文章,但实际临床转化和应用却严重受限。
针对以上问题,朱麟勇教授带领团队的青年教师林秋宁以及包春燕教授,于2012年开启了光交联水凝胶生物材料创新构建与临床转化的艰辛道路,并取得了一系列科研成果:2014年,朱麟勇课题组另辟蹊径,在国际上率先提出了“光偶联反应”非自由基交联机制(Adv. Mater. 2014, 26, 3912; Adv. Mater. 2015, 27, 1647)(见图A),实现了水凝胶的低毒、可控构筑,有效克服传统光交联机制自由基毒性的缺陷,被业内赞誉为“光交联水凝胶技术的新突破”;2015年,实现了“光偶联反应”交联的多步可控化(Angew. Chem. Int. Ed., 2015, 54, 174);2017年,基于“光偶联反应”,实现了细胞在水凝胶支架内粘附、增殖与迁移等行为的操控(Adv. Funct. Mater., 2017, 27, 1606258);2018年,进一步拓展了“光偶联反应”在多波长调控、大尺度与深厚度的水凝胶材料的3D快速光交联成型的应用(Angew. Chem. Int. Ed., 2018, 57, 3722)。以上“光偶联反应”交联突破了传统自由基机制的诸多壁垒,成功实现了光交联水凝胶的可控与低毒的有效结合。

图A:提出“光偶联反应”非自由基交联机制
为进一步突破传统意义上“柔弱”“光滑”的水凝胶无法与潮湿、动态的组织表面粘附固定的挑战,朱麟勇研究团队提出发展能够与组织表面氨基共价键合的“光偶联反应”,建立了具有组织粘附与整合特性的光原位凝胶技术(Adv. Mater., 2016, 28, 2724; Adv. Funct. Mater., 2018, 28, 1706918)(见图B),技术一经发表就被“Global Medical Discovery”(全球医药发现)作为“Key Scientific Article”(重要的科学论文)加以报道。
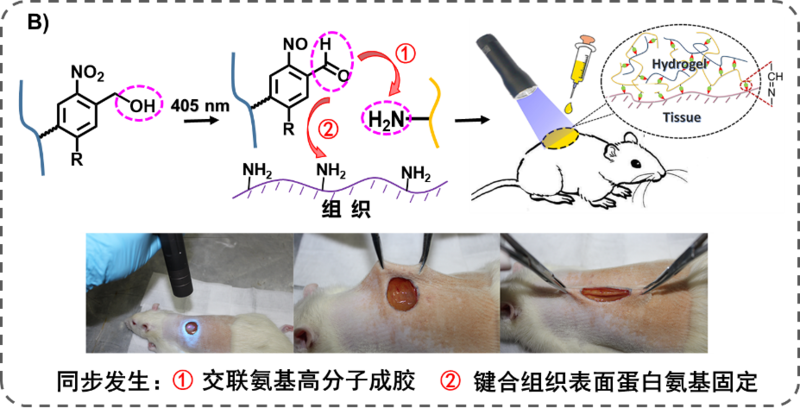
图B:建立具有组织粘附与整合特性的光原位凝胶技术
基于这些技术优势,朱麟勇研究团队于2014年进一步与相关医学单位合作,在动物模型上验证以上光原位凝胶技术的有效性(见图C、D、E)。经过验证证实,该水凝胶材料具有以下几方面作用:一是可作为创面止血封闭材料,其高强度、强组织粘附与快速固化的特征可实现大动物心脏穿透伤导致大流量出血与动脉损伤的瞬时封闭(Nat. Commun., 2019, DOI: 10.1038/s41467-019-10004-7);二是可作为干细胞或其外泌体原位凝胶支架,其组织粘附特性有助于软骨缺损的修复,并促进新生软骨与旧软骨间的整合一体化(Nanoscale, 2017, 9, 4430);三是可作为创面的促修复材料,在无需任何改性条件下,促使自体富含血小板的血浆(PRP)发生“光偶联反应”交联,原位形成高组织粘附力的促创面修复凝胶(Acta Biomaterialia, 2017, 62, 179)。
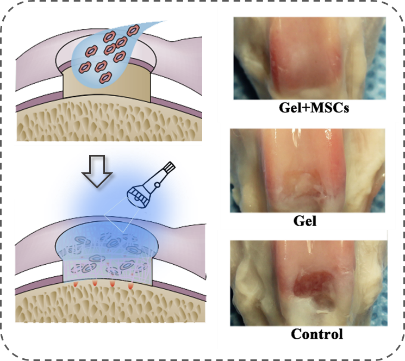
图C:应用示例一:作为原位支架包载外泌体用于软骨缺损修复
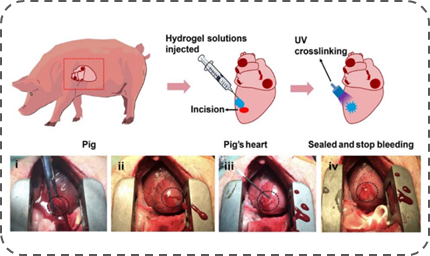
图D:应用示例二:作为大动物心脏穿刺伤止血材料
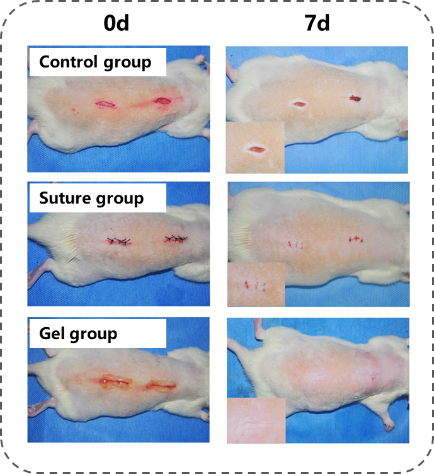
图E:应用示例三:作为急性创面免缝合材料
基于以上“光偶联反应”原位凝胶技术具有生物安全、简单易用及特有的组织粘附与整合的优势,朱麟勇研究团队在完成对以上技术的原料、制备、产品及应用的知识产权全面布局的基础上,进一步与相关医学单位和企业合作,实施基于该原创技术的“医用光敏生物胶”产品的临床转化,先后完成了材料的中试生产、储存稳定性、动物模型的有效性以及第三方安全性认证(CFDA认证机构)。
“期望该‘医用光敏生物胶’产品能在近期内通过CFDA创新医疗器械通道,最终获批三类医疗器械注册证,实质上突破当前‘纤维蛋白原’和‘氰基丙烯酸酯’医用胶在潮湿组织表面无粘接以及生物毒性等应用瓶颈。”朱麟勇教授说。
截至目前,围绕“光偶联反应”原位凝胶技术,朱麟勇教授课题组已申请国内发明专利6项,国际PCT专利3项;已获中国发明专利授权1项和美国发明专利授权1项,提交美国专利2项、欧洲专利1项、日本专利1项。
