RNA疫苗如何在新冠疫情中弯道超车?

这项技术有望彻底改变艾滋病、疟疾、流感等疾病的免疫接种。
2013年3月的一个周五下午,Andy Geall接到了一个电话。当时,中国有三名人员刚刚感染了一种新型禽流感病毒毒株,诺华公司国际疫苗研究负责人Rino Rappuoli想知道Geall及其同事是否准备好借此机会测试他们的新疫苗技术。
就在2012年,诺华美国研究中心(位于马萨诸塞州剑桥市)的Geall团队将RNA核苷酸片段打包进小脂肪滴——脂质纳米颗粒(LNP),成功地给大鼠接种了一种呼吸道病毒疫苗[1]。现在,他们能否将同样的技术以最快的速度应用在新的流感病毒株上?
身为RNA组的负责人,Geall回想起当时的情景:“我当时说,‘嗯,当然可以。把序列发给我就行。’”周一,Geall的团队开始合成RNA,周三便开始组装疫苗;周末已经可以在细胞里测试疫苗,一周后开始在小鼠体内测试疫苗[2]。
这样的研发速度快到惊人[3]。这支诺华团队仅用一个月就完成了通常需要一年或更长时间才能走完的流程。
但是,当时生产临床级RNA疫苗的能力有限。Geall和同事永远无法知道这款疫苗以及他们开发的若干其他疫苗是否对人类有效。2015年,诺华出售了其疫苗业务。

疫苗生产车间迅速提升了RNA疫苗的产能。来源:Olivier Maire/EPA-EFE/Shutterstock
5年过去了,全球经历了新冠大流行,RNA疫苗的价值也开始显现。2020年12月,两种RNA候选疫苗——一种来自美国制药巨头辉瑞和德国公司BioNTech,另一种来自美国公司Moderna——获得了多个国家监管机构的紧急使用授权,用于抗击COVID-19。
RNA疫苗的时代已经到来,几十家公司正在入局。“所有的大型制药公司都在以某种方式测试这项疫苗技术。”Jeffrey Ulmer说。Ulmer是葛兰素史克疫苗分部(位于美国马里兰州洛克维尔市)的临床前研究负责人,之前曾是诺华Geall团队的成员。
在疫苗中使用RNA的想法已经提出近三十年了。这项基因技术比传统方法简单,研究人员可以快速推进疫苗研发的多个阶段。现在人们对它的浓厚兴趣或许会带来对付肺结核、艾滋病和疟疾等顽疾的方法。生产RNA疫苗的速度优势也可以改进季节性流感疫苗。
但在未来,这项技术的应用还是会遇到一些挑战,比如原材料昂贵,不良反应引人担忧,以及目前冷链分发的成本较高——辉瑞-BioNTech的新冠疫苗就必须存储在零下70 °C。对于这些问题,COVID-19的紧迫性可能会加速一些进展,但是眼前的危机一旦消除,许多公司可能又会抛弃该策略。问题来了:RNA技术最终将走向何处?
“RNA技术已经证明了其价值,但是这还不够,”辉瑞病毒疫苗研究负责人、Geall在诺华的前同事Philip Dormitzer说,“我们已经看到了它对COVID-19有效,肯定还想尝试更多。”
小颗粒、大进展
疫苗能教会机体识别病原体并摧毁它们。一般情况下,疫苗接种让弱化的病原体或是其表面的蛋白/糖片段(称为抗原)注射到机体内,训练免疫系统识别入侵者。但是,RNA疫苗只携带用于制造这些入侵者蛋白的指令。它的目标是进入人体细胞,让人体细胞制作这些抗原,本质上是将机体转变为其自身的“疫苗工厂”。
RNA疫苗的概念可追溯至上世纪90年代。当时,(现在的赛诺菲巴斯德医药公司的)法国研究人员率先在小鼠体内使用RNA编码了一种流感抗原[4]。结果产生了免疫反应,但是他们使用的脂质递送系统对人类而言毒性太大。又过了十年,才有公司将目光转向RNA干扰疗法——这种疗法依赖于RNA选择性地阻断特定蛋白生成的能力——最后发现了使今天的新冠疫苗成为可能的LNP技术。

疫苗生产车间提升了RNA疫苗的产能。来源:Robin van Lonkhuijsen/ANP/AFP/Getty
“最后终于取得了突破。”流行病防范创新联盟的项目及创新技术负责人Nick Jackson说,“那真的是一个分水岭,标志着信使RNA可以应用于一系列完全不同的疾病适应症了。”流行病防范创新联盟是一个致力于加速疫苗研发的国际合作组织。
2012年,就在Geall和同事描述了首款LNP封装的RNA疫苗[1]前后,美国国防高级研究计划局(DARPA)开始资助诺华、辉瑞、阿斯利康、赛诺菲巴斯德等团队研究RNA编码的疫苗和疗法。但是,这些大公司都没有坚持下来。“即使数据看起来不错,但它们对于新的疫苗调控通路所涉及的风险非常谨慎。”DARPA的前项目经理Dan Wattendorf说。
不过,和这个DARPA项目有关联的两个小公司坚持了下来,一个是德国的CureVac公司。CureVac于2013年开始在人体内测试一种狂犬病疫苗[5],目前也有一款新冠疫苗处于后期测试中。
另一家公司是Moderna。以DARPA资助的研究为基础,Moderna最终在2015年末将一种针对某新型禽流感毒株的RNA疫苗推进到了临床试验阶段。该疫苗能诱导很强的免疫应答[6],于是Moderna进一步开展了RNA疫苗对巨细胞病毒(导致出生缺陷的一种常见原因)、两种蚊媒病毒(基孔肯雅病毒和寨卡病毒)、三种儿童呼吸道疾病的致病病毒的人体试验。
2019年,葛兰素史克(曾收购诺华的大部分疫苗业务)也开始评价一种狂犬病RNA疫苗。
以上便是RNA疫苗到2020年初的全部临床进展:仅12种候选疫苗进入人体试验;4种疫苗在初始测试后被迅速放弃;只有1种针对巨细胞病毒的疫苗开展了更大规模的后续研究。
之后,新冠病毒出现了,随之而来的还有“巨大的关注”,南非金山大学的基因疗法研究员Kristie Bloom形容道。单是过去10个月,就有至少6种基于RNA的新冠疫苗进入人体试验。还有好几种在向临床试验进发。
速度要求
RNA疫苗仿佛是专为速度而生的。利用病原体的基因序列,研究人员可以快速得到一个潜在的抗原编码片段,将该序列插入一个DNA模板中,合成相应的RNA,再将疫苗封装起来递送至机体内。
举例来说,Moderna在得到新冠病毒基因组序列后,短短4天内就完成了上述流程。它用的是新冠病毒的刺突蛋白——这是病毒借以进入细胞的一种表面蛋白。之后,Moderna与美国国立卫生研究院合作,先用小鼠开展了概念验证试验,再启动了首个人体试验,前后不过两个月的时间。
理论上,任何疫苗都能以同样的方式研制。“从这个意义上说,它确实是一个平台。”赛诺菲巴斯德的疫苗研发负责人John Shiver说。利用RNA,“你不需要再造整个过程。”
相比之下,传统的疫苗制作方法要求对每一种候选疫苗专门设计耗时费钱的步骤。这种低效的流程解释了为何卫生机构必须在流感季到来之前的几个月,就决定在当年的季节性流感疫苗中放入哪些毒株。这些选择通常会有失误,但是也没时间回去测试替代选项。正因为此,流感疫苗的有效性很少超过60%。
而RNA就不同了,疫苗厂商可以更快地找出有效抗原。“理论上,你可以很快改变序列来做出调整,几乎是即时反应。”Translate Bio公司的首席执行官Ron Renaud说。Translate Bio位于马萨诸塞州列克星敦市,是一家专注于RNA的公司,正在与赛诺菲巴斯德合作研究针对流感、新冠和其他病毒性和细菌性病原体的RNA疫苗。
RNA疫苗因其“即插即用”的特性,有助于开展基础研究。伊利诺伊大学医学院的疫苗学家Justin Richner正在自己的实验室研发一种基于RNA的登革热疫苗。Richner和同事会例行切割和改变编码包膜蛋白的基因序列——登革热病毒正是利用这些蛋白攻击人体细胞。通过设计迭代,研究人员已经在小鼠身上测试了约15种候选疫苗。
“我们可以轻松地操控这种疫苗的编码序列,尝试新的假设和策略,寻找更好的疫苗。”Richner说。
其他价值
RNA技术的进步正在帮助研究人员接近疫苗研发的一些圣杯问题,比如通用流感病毒疫苗——适用于任何流感病毒株的疫苗,无需每年重新设计。另一些研究人员更关注艾滋病毒和低收入国家的其他致命病毒的疫苗。这类疫苗非常难获得,因为病原体会系统性地改变其表面蛋白,以逃避免疫系统的识别。疟疾等感染原还具有复杂的生命周期,使得选取抗原的过程难上加难。
RNA疫苗可以包含多个抗原的指令,它们或是串联成一条单链,或是若干个RNA封装在一个纳米粒中。
宾夕法尼亚大学佩雷尔曼医学院的疫苗科学家Norbert Pardi采用了后一种方法来制作他的实验性流感疫苗。这种复合疫苗由四个RNA链组成,每一个编码不同的流感蛋白,能帮助小鼠预防一种流感病毒亚型的感染[7]。
现在,Pardi和他在西奈山伊坎医学院的合作者希望在另外两种主要的病毒亚型上重复该做法,再全部融入一种12价流感疫苗,这有望免去每年接种流感疫苗的必要。“如果你对病毒进行多点攻击,”Pardi说,“你就可以诱导广谱的保护性免疫应答。”
稳定性和安全性
虽然如今的RNA疫苗技术具有许多潜在优势,但仍有提升空间。“这项技术仍在发展初期,”帝国理工学院的免疫学家Robin Shattock说,“我预计该技术未来几年还会有好几轮迭代。”
首先是低温储存的问题。辉瑞-BioNTech和Moderna疫苗都需要在低温下存放,才能保持RNA的完整性。
不过,至少有两家公司称它们的新冠RNA疫苗可以在更高温度下存放几个月。
CureVac使用的LNP和辉瑞-BioNTech的一样,它将RNA折叠为很小的3D结构,支持在冷藏温度下存储几个月,公司首席技术官Mariola Fotin-Mleczek说。中国苏州艾博生物科技目前有一种新冠RNA疫苗处于早期人体试验阶段,公司很重视LNP的质量和纯度,致力于研制一种能在室温下保持一周效力的疫苗[8]。
还有一个问题:目前用于人体对抗COVID-19或其他疾病的RNA疫苗一般需要两剂才有效。考虑到其他多剂量疫苗的接种依从性较差,许多注射了第一剂的人可能不会注射第二剂。
新型递送系统有望解决这个问题。马萨诸塞州Vaxess技术公司的研究人员研发出了一种可穿戴的皮肤贴,上面布满丝样尖头的可溶微针,微针会缓慢地将疫苗送入体内。
用点滴的方式注射疫苗而不是一次性注射,或有助于解决第三个问题:不良反应。严重反应虽然只是暂时性的,但在新冠疫苗中似乎比其他疫苗更常见。在临床试验接种了Moderna疫苗的人,有80%产生了某种系统性的接种反应,包括疲劳、肌肉疼痛和其他会使人短暂无力的反应。
面对危及生命的全球疫情,这些副作用或许是可以接受的,在多家疫苗厂商担任顾问的疫苗学家Stanley Plotkin说。但是,人们可能不愿意每年体验接种流感疫苗的那种难受。对于给婴儿接种疫苗,“人们肯定希望反应小一点。”
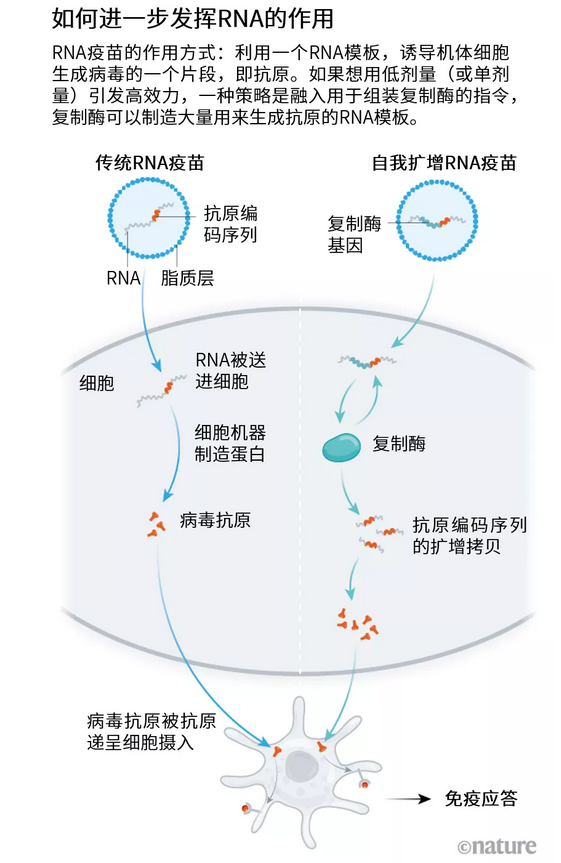
疫苗合成和LNP递送系统中的污染物被认为是反应原性的两大主要来源。纯化系统的能力有限,LNP也只能优化到这个程度。因此,疫苗厂商通常会注射较低的剂量,以限制机体对这两种污染物的暴露。就传统的RNA疫苗而言,低剂量意味着低效力。但是,加州Arcturus Therapeutics和伦敦VaxEquity等公司已经设计出了变通方法——为其新冠疫苗构建能自我扩增的RNA(见“如何进一步发挥RNA的作用”)。
减剂量
几种领跑的RNA疫苗仅包含新冠病毒刺突蛋白的编码序列,两端为调节区域,与此不同的是,能自我复制的候选疫苗还包括RNA用来自我复制的指令。
这样的疫苗构造有点“笨重”,需要更多的序列优化和生产技巧。但是,它可以让疫苗公司降低剂量。复制的RNA可以更好地模仿自然病毒感染过程——触发更强、更广谱的免疫应答,这或许能支持单剂量接种方案。
Nik Spencer/Nature
BioNTech公司已经改进了扩增技术[9]。在新冠疫情暴发前,BioNTech主要侧重于研发癌症疫苗。但是公司较好的声誉、已扩大的产能,以及可期的新冠疫苗销售前景所带来的充足现金流,“这些因素让我们在传染病的平台上可以更快地扩张。”BioNTech联合创始人兼首席执行官Uğur Şahin说。
比利时Ziphius疫苗公司也想抓住新冠病毒带来的机遇。Ziphius成立于2019年5月,最初的目标是开发针对罕见病(如杜氏肌营养不良和囊性纤维化)的RNA疗法。去年,公司改变了原来的研发方向,开始研究自我扩增的新冠RNA疫苗。这家初创公司的首席执行官Chris Cardon表示,Ziphius目前正在尝试募集3000万欧元(3700万美元),用以推进14项针对各种传染病的临床前项目。
RNA疫苗可能也会遇到财务瓶颈。许多业内人士预计,目前一拥而上的局面很难持续到疫情平息之后。
“说服人们押注这种技术来研发传染病疫苗真的很难。”加州Replicate生物技术公司的首席执行官Nathaniel Wang说。去年,他和Geall共同成立了这家公司,目标是研发癌症RNA疗法。虽然Replicate已经和一些学术机构及商业伙伴在新冠和寨卡病毒的RNA疫苗上建立了合作,但是大部分风投公司的投资意向并不大,Wang说。
尽管如此,RNA疫苗依然屡见报端,Geall和他的许多前同事也回到了他们之前在诺华做的工作。如果诺华当初没有出售疫苗部门,过去十年里,他们是否已经能让埃博拉或寨卡病毒销声匿迹?
“回头看总是有些伤感。”诺华疫苗部门前研究及早期临床研发负责人Christian Mandl说。但是,新冠疫苗如今取得的成功也让他感到欣慰。“我们做出了有价值的贡献,我引以为豪。”
参考文献:
1. Geall, A. J. et al. Proc. Natl Acad. Sci. USA 109, 14604–14609 (2012).
2. Hekele, A. et al. Emerg. Microbes Infect. 2, e52 (2013).
3. Ulmer, J. B., Mansoura, M. K. & Geall, A. J. Expert Opin. Drug Discov. 10, 101–106 (2015).
4. Martinon, F. et al. Eur. J. Immunol. 23, 1719–1722 (1993).
5. Alberer, M. et al. Lancet 390, 1511–1520 (2017).
6. Feldman, R. A. et al. Vaccine 37, 3326–3334 (2019).
7. Freyn. A. W. et al. Mol. Ther. 28, 1569–1584 (2020).
8. Zhang, N.-N. et al. Cell 182, 1271–1283 (2020).
9. Beissert, T. et al. Mol. Ther. 28, 119–128 (2020).
原文以How COVID unlocked the power of RNA vaccines为标题发表在2021年1月12日的《自然》的新闻特写版块
© nature
doi:10.1038/d41586-021-00019-w
